
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学知识的回答:
(1)实验测得室温下0.1mol/LNaHCO3溶液的pH>7,则Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:_______________________________________________________________。
(2)含有足量AgCl固体的饱和溶液中,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq)。在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
① 100mL蒸馏水中;
② 100mL 0.2mol/LAgNO3溶液中;
③ 100mL 0.1mol/L氯化铝溶液中;
④ 100mL 0.1mol/L盐酸溶液中.
充分搅拌后,相同温度下银离子浓度由大到小的顺序_________________________(填写序号);②中氯离子的浓度为_________mol/L。
【答案】 c(Na+)>c(HCO3-)>c(OH-)> c(H2CO3)> c(CO32-) ②①④③ 9×10-10
【解析】(1)NaHCO3溶液中存在电离平衡和水解平衡,HCO3-+H2O![]() H2CO3+OH-;HCO3-
H2CO3+OH-;HCO3-![]() H++CO32-;H2O
H++CO32-;H2O![]() H++OH-;溶液的pH>7,所以水解大于电离,所以则Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)> c(H2CO3)> c(CO32-);正确答案:c(Na+)>c(HCO3-)>c(OH-)> c(H2CO3)> c(CO32-)。
H++OH-;溶液的pH>7,所以水解大于电离,所以则Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)> c(H2CO3)> c(CO32-);正确答案:c(Na+)>c(HCO3-)>c(OH-)> c(H2CO3)> c(CO32-)。
(2)含有足量AgCl固体的饱和溶液中存在AgCl(s)![]() Ag+(aq)+Cl-(aq)平衡,① 加入100mL蒸馏水,仍为该温度下饱和液,c(Ag+)浓度不变;②加入 100mL 0.2mol/LAgNO3溶液,c(Ag+)增大,平衡左移,c(Ag+)增加的多;③ 加入到100mL 0.1mol/L氯化铝溶液中,c(Cl-)=0.3mol/L,c(Cl-)增大,平衡左移,c(Ag+)减小;④ 加入100mL 0.1mol/L盐酸溶液中,c(Cl-)=0.1mol/L,c(Cl-)增大,平衡左移,c(Ag+)减小;但是由于③溶液中c(Cl-)大于④溶液中的c(Cl-),所以③对上述沉淀溶解平衡抑制程度大,c(Ag+)减小的多;相同温度下银离子浓度由大到小的顺序:②①④③ ;根据氯化银的Ksp=1.8×10-10mol2/L2,Ksp= c(Ag+)×c(Cl-)=1.8×10-10,c(Ag+)=0.2 mol/L,c(Cl-)=9×10-10 mol/L;正确答案:②①④③;9×10-10。
Ag+(aq)+Cl-(aq)平衡,① 加入100mL蒸馏水,仍为该温度下饱和液,c(Ag+)浓度不变;②加入 100mL 0.2mol/LAgNO3溶液,c(Ag+)增大,平衡左移,c(Ag+)增加的多;③ 加入到100mL 0.1mol/L氯化铝溶液中,c(Cl-)=0.3mol/L,c(Cl-)增大,平衡左移,c(Ag+)减小;④ 加入100mL 0.1mol/L盐酸溶液中,c(Cl-)=0.1mol/L,c(Cl-)增大,平衡左移,c(Ag+)减小;但是由于③溶液中c(Cl-)大于④溶液中的c(Cl-),所以③对上述沉淀溶解平衡抑制程度大,c(Ag+)减小的多;相同温度下银离子浓度由大到小的顺序:②①④③ ;根据氯化银的Ksp=1.8×10-10mol2/L2,Ksp= c(Ag+)×c(Cl-)=1.8×10-10,c(Ag+)=0.2 mol/L,c(Cl-)=9×10-10 mol/L;正确答案:②①④③;9×10-10。


科目:高中化学 来源: 题型:
【题目】下列下列说法不正确的是 ( )
A. 铅蓄电池放电时正极的工作原理为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,其充电时阴极的反应式:PbSO4+2e-═Pb+SO42-
B. 碱性锌锰干电池放电时,负极反应式:Zn-2e-═Zn2+
C. 碱性镍氢电池放电时负极反应式:H2-2e-+2OH-═2H2O
D. 某锂离子电池的总反应式为:Li+2Li0.35NiO2![]() 2Li0.85NiO2,则其充电时阳极反应式为:2Li0.85NiO2-e-═2Li0.35NiO2+Li+
2Li0.85NiO2,则其充电时阳极反应式为:2Li0.85NiO2-e-═2Li0.35NiO2+Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定休积的密闭容器中,充入2molA和1molB,发生如下反应2A(g)+B(g)![]() xC(g) 平衡后,C的体积分数为W%,若维持容器容君和温度不变,0.6molA、0.3molB和1.4molC为起始物质。达到平衡后,C的体形分數也为W%。平衡后若缩小容器体积,C的体和分数C%、混合气体平均相对分子质量(M)、平衡常数(K)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
xC(g) 平衡后,C的体积分数为W%,若维持容器容君和温度不变,0.6molA、0.3molB和1.4molC为起始物质。达到平衡后,C的体形分數也为W%。平衡后若缩小容器体积,C的体和分数C%、混合气体平均相对分子质量(M)、平衡常数(K)和正反应速率[V(正)],随压强(P)的变化,一定符合的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下,CH4和CO2都能与H2O形成如下图所示的笼状结构(表面的小球是水分子,内部的大球是CH4分子或CO2分子;“可燃冰”是CH4与H2O形成的水合物),其相关参数见下表。
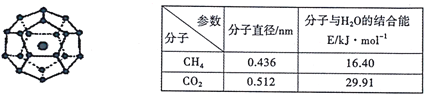
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为_______;碳原子的最高能级的符号是_______,其电子云形状是_______。
(2)CO2分子中碳原子的杂化轨道类型为_______,分子的立体构型为_____。CO2与SO2相同条件下在水中的溶解度较大的是SO2,理由是________。
(3)为开采海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_______。
(4)“可燃冰”中分子间存在的作用力是氢键和_________,上图中最小的环中连接的原子总数是_______。
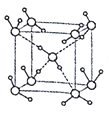
(5)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的1.5 倍。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰- Ⅶ的晶体结构为一个如图所示的立方晶胞,每个水分子与周围4个水分子以氢键结合。设O-H…O距离为apm,阿伏加德罗常数的值为NA,则该冰- Ⅶ晶体的密度为____ g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度: A<C<B
D. D点溶液中:c(Cl-)+ 2c(H+)=2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10ml 0.40mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6min的平均反应速率: v(H2O2)≈3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率: v(H2O2)<3.3×10-2mol/(L·min)
C. 反应至6min时, c(H2O2)=0.30mol·L-1
D. 反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间不能通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| SiO2 | Na2SiO3 | Si | H2SiO3 |
B | Na2O | Na2O2 | Na | NaOH | |
C | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
D | FeCl2 | FeCl3 | Fe | CuCl2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com