
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
【答案】B
【解析】R原子最外层电子数是电子层数的2倍,可能为C或S,由于图示原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Z与T形成的Z2T化合物能破坏水的电离平衡,T应为S,Na2S水解呈碱性,可促进水的电离;X的原子半径最小,原子序数最小,应为H元素。A.原子半径O<Na,离子半径O2->Na+,故A错误;B.R为C,对应的氢化物为烃,如含碳原子数较多,常温下为固体,沸点较高,则氢化物的沸点不一定是:Y>R,故B正确;C.非金属性S>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C错误;D.由H、C、O、Na四种元素组成的化合物不仅仅为NaHCO3,可能为有机盐且含有羧基,溶液不一定为碱性,可能为酸性,故D错误;故选B。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,其中A着火只能用干燥的沙土灭火,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。

(1)写出A、B、F的化学式 A______ B ______ F ______。
(2)写出A和D反应生成B和C的化学方程式_____________。若生成3mol的B,则转移的电子数目为_______________ 。
(3)写出E与C、D反应生成的B和F离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钻酸锂电池成用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑。铝箔及少量Fe,可通过下列实验方法回收钴、锂。
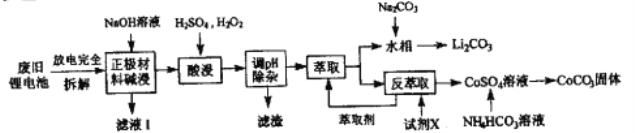
几种金属离子沉淀完全(离子浓度为10-5mol/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)LiCoO2中,Co元素的化合价为_______,滤液I的主要成分是______。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是______。“调节pH”除去的离子主要有Al3+和____。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2![]() Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
(2)用托盘天平称取氯化钠固体,其质量为__________ g。
(3)下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学知识的回答:
(1)实验测得室温下0.1mol/LNaHCO3溶液的pH>7,则Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:_______________________________________________________________。
(2)含有足量AgCl固体的饱和溶液中,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq)。在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
① 100mL蒸馏水中;
② 100mL 0.2mol/LAgNO3溶液中;
③ 100mL 0.1mol/L氯化铝溶液中;
④ 100mL 0.1mol/L盐酸溶液中.
充分搅拌后,相同温度下银离子浓度由大到小的顺序_________________________(填写序号);②中氯离子的浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是

A. I表示的是滴定醋酸的曲线
B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为常见的非金属单质且常温下均为气体,甲、乙为金属单质,乙在I的浓溶液中发生钝化,C为极易溶于水的气体而且水溶液呈碱性,而H为一种强碱,各物质间的转化关系如下图(部分生成物末给出,且未注明反应条件):

(1)已知D为无色气体遇氧气随即变为红棕色气体G,则上述转化关系的反应④中,每反应消耗3mol G,转移电子的物质的量为___________mol。
(2)实验室制取C物质的化学方程式为:__________________。
(3)已知上述转化关系中反应⑥的发生一般是将H溶于水得到强碱溶液再与金属乙混合,此时看到金属乙溶解且表面冒气泡,请写出反应⑥的离子方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应)。下列说法不正确的是

A. 常温下,HA的电离常数K(HA)约为10-5
B. v1<20
C. 溶液中水的电离程度:a点>b点
D. 滴定过程为了确定滴定终点,最合适的指示剂是酚酞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com