
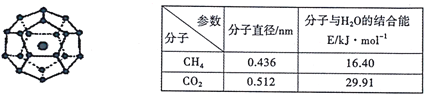
【题目】2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下,CH4和CO2都能与H2O形成如下图所示的笼状结构(表面的小球是水分子,内部的大球是CH4分子或CO2分子;“可燃冰”是CH4与H2O形成的水合物),其相关参数见下表。
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为_______;碳原子的最高能级的符号是_______,其电子云形状是_______。
(2)CO2分子中碳原子的杂化轨道类型为_______,分子的立体构型为_____。CO2与SO2相同条件下在水中的溶解度较大的是SO2,理由是________。
(3)为开采海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_______。
(4)“可燃冰”中分子间存在的作用力是氢键和_________,上图中最小的环中连接的原子总数是_______。
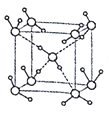
(5)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的1.5 倍。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰- Ⅶ的晶体结构为一个如图所示的立方晶胞,每个水分子与周围4个水分子以氢键结合。设O-H…O距离为apm,阿伏加德罗常数的值为NA,则该冰- Ⅶ晶体的密度为____ g/cm3(列出计算式即可)。
【答案】 O>C>H 2p 哑铃形 sp 直线型 SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大 CO2的分子直径小于笼状空腔直径,且与H2O的结合力大于CH4 范德华力 10 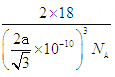
【解析】(1)一般来说,元素的非金属性越强,电负性越强,所以顺序为:O>C>H。碳为第6号元素,原子核外有6个电子,其最高能级为2p。p电子云的形状是哑铃形。
(2)根据价层电子对互斥理论,CO2的中心原子C的价电子对为2+(4-2×2)=2对,所以CO2的空间构型为直线型,C的杂化类型为sp杂化。CO2为直线型分子,所以是非极性分子,而SO2为折线形,所以是极性分子,根据相似相溶的原理,SO2在极性溶剂(水)中的溶解度更大。
(3)已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,得到CO2分子的直径小于空腔直径,可以嵌入笼状结构中,同时二氧化碳与水分子的结合能高于甲烷,说明二氧化碳更易于与水结合,有可能将已经嵌入笼中的甲烷置换出来。
(4)分子之间存在的力除氢键以外,只可能是范德华力。图中最小的环是由5个水分子通过氢键构成的,其结构为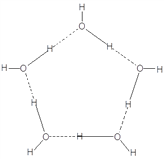 ,其中虚线代表氢键,实线代表共价键,所以最小的环中连接的原子为10个。
,其中虚线代表氢键,实线代表共价键,所以最小的环中连接的原子为10个。
(5)该晶胞中含有的水分子为:8×![]() + 1×1=2个,所以晶胞的质量为2×18÷NA=
+ 1×1=2个,所以晶胞的质量为2×18÷NA=![]() g。从图中得到O-H…O距离为该立方体晶胞的体对角线长度的一半,所以得到该晶胞的边长为
g。从图中得到O-H…O距离为该立方体晶胞的体对角线长度的一半,所以得到该晶胞的边长为![]() ,所以密度为
,所以密度为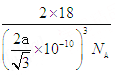 g/cm3。
g/cm3。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,其中A、B、C焰色反应均为黄色,而D的焰色反应为紫色,A、C和盐酸反应均得到B,将固体A加热分解可得到C,若在C的溶液中通入一种无色无味气体,又可得到A的溶液;若D的溶液滴加到FeCl2溶液中,先出现白色沉淀迅速变成灰绿色,最后变成红褐色沉淀E。
(1)试推断各物质的化学式A:_____、B:_____、C:_______、D:_______、E:______
(2)按要求写出下列方程式:
①A与盐酸反应的离子方程式:__________________________;
②A固体受热分解的化学方程式:______________________;
③D溶液滴加到FeCl2溶液中出现白色沉淀及最后变成红褐色沉淀的相关化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
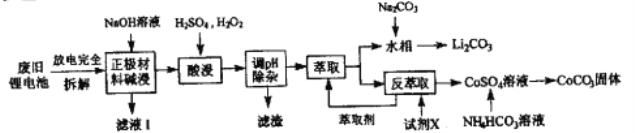
【题目】钻酸锂电池成用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑。铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5mol/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)LiCoO2中,Co元素的化合价为_______,滤液I的主要成分是______。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是______。“调节pH”除去的离子主要有Al3+和____。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2![]() Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)共建“带一路”符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。
下列贸易商品中,主要成分属于无机物的是______(填标号)

(2)下列有关有机化合物的说法正确的是__________ (填标号,3分)
A.棱晶烷(![]() )与苯互为同分异构体
)与苯互为同分异构体
B.分子式为C8H10的芳吞烃有3种不同的线构
C. ![]() 能发生取代、加成、氧化、水解等反应
能发生取代、加成、氧化、水解等反应
D.丙烯酸(CH2=CHCOOH) 与山梨酸(CH3CH=CHCH=CHCOOH) 为同系物
(3)完全燃烧甲烷和乙烯的混合气体1.12L (标准状况下),生成气体进入足量澄清石灰水中,得到6g沉淀。则混合气体中甲烷和乙烯的体积比为_________(填标号,3分)
A.1:1 B.1:2 C.2:1 D.4 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
(2)用托盘天平称取氯化钠固体,其质量为__________ g。
(3)下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学知识的回答:
(1)实验测得室温下0.1mol/LNaHCO3溶液的pH>7,则Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:_______________________________________________________________。
(2)含有足量AgCl固体的饱和溶液中,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq)。在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
① 100mL蒸馏水中;
② 100mL 0.2mol/LAgNO3溶液中;
③ 100mL 0.1mol/L氯化铝溶液中;
④ 100mL 0.1mol/L盐酸溶液中.
充分搅拌后,相同温度下银离子浓度由大到小的顺序_________________________(填写序号);②中氯离子的浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
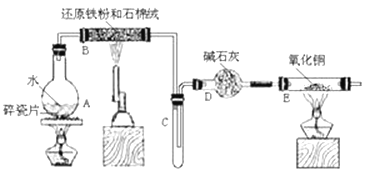
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验。(图中夹持及尾气处理装置均已略去)
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_________________________________。
装置B中发生反应的化学方程式是___________________________________。
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行________________________, 装置E中的现象是_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com