
【题目】利用固体氧化物电解池(SOEC)可实现乙烷电化学脱氢制乙烯,原理示意图如下所示。下列说法错误的是
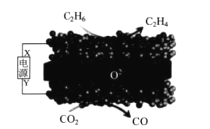
A.X 是电源的正极
B.该装置在工作过程中,O2-在固体氧化物中由下方向上方迁移
C.阴极区发生的反应为:CO2+2e-+2H+=CO+H2O
D.该过程的总反应方程式为:C2H6+CO2=C2H4+CO+H2O
【答案】C
【解析】
如图所示,二氧化碳通过电解转变为一氧化碳,碳元素化合价降低,得电子,被还原,则与Y相连的电极为阴极,与X相连的电极为阳极,与阴极相连的为电源负极,则X为电源正极,Y为电源负极。
A.根据分析,X 是电源的正极,故A正确;
B.该装置在工作过程为电解池,电解池中阴离子向阳极移动,根据分析该电解池下方是阴极,上方是阳极,则O2-在固体氧化物中由下方向上方迁移,故B正确;
C.利用固体氧化物做电解质电解,不会产生氢离子,则阴极区发生的反应为:CO2+2e-=CO+O2-,故C错误;
D.根据电解原理示意图所示,结合物料守恒和电荷守恒,该过程的总反应方程式为:C2H6+CO2=C2H4+CO+H2O,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列“实验结论”与“实验操作及现象”不相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向KI―淀粉溶液中滴加氯水,溶液变成蓝色 | 氧化性:Cl2>I2 |
B | 向蔗糖中滴加浓硫酸,蔗糖变黑 | 浓硫酸有吸水性 |
C | 向某盐溶液中滴加KSCN溶液,溶液变为红色 | 该溶液中含有Fe3+ |
D | 向某盐溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
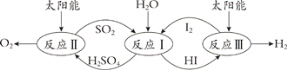
已知:
反应I:SO2(g) + I2(g) + 2H2O(l) = 2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1
反应II:H2SO4(aq) = SO2(g) + H2O(l) +1/2O2(g) ΔH2= +327 kJ·mol-1
反应III:2HI(aq) = H2(g) + I2(g) ΔH3= +172 kJ·mol-1
则反应2H2O(l) = 2H2(g)+O2(g) ΔH= ________。
(2)H2S可用于高效制取氢气,发生的反应为2H2S(g)S2(g)+2H2(g)。
Ⅰ.若起始时容器中只有H2S,平衡时三种物质的物质的量与裂解温度的关系如图:
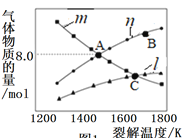
①图中曲线1表示的物质是________________(填化学式)。
②A点时H2S的转化率为__________________。
③C点时,设容器内的总压为pPa,则平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
II.若在两个等体积的恒容容器中分别加入2.0mol H2S、1.0mol H2S,测得不同温度下H2S的平衡转化率如图所示:
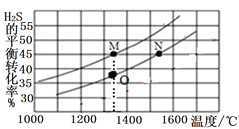
①M点和O点的逆反应速率v(M)______v(O) (填“>”“<”或“=”,下同);
②M、N两点容器内的压强2P(M)_____P(N),平衡常数K(M)_____K(N)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说法正确的是
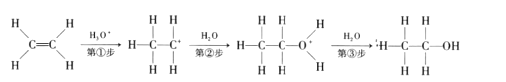
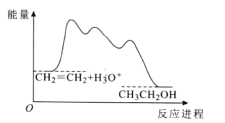
A.①、②、③三步反应均释放能量
B.该反应进程中有两个过渡态
C.第①步反应的活化能最小
D.总反应速率由第①步反应决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取Ni2O3.已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
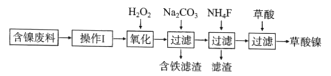
回答下列问题:
(1)“操作I”为“酸浸”,为了提高酸浸的效率,可以采取的措施为__________(写出两条)。
(2)加入H2O2发生的主要反应的离子方程式为________________
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是___________________
(4)将草酸镍(NiC2O4·2H2O)在热空气中干燥脱水,再采用高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为水蒸气和_________________
(5)工业上还可用电解法制取Ni2O3用NaOH溶液调 NiCl2,溶液的pH至7.5,加入适量Na 2SO4后利用惰性电极电解。电解过程中产生的Cl2,有80%在弱碱性条件下生成CIO-,再把二价镍氧化为三价镍。CIO-氧化Ni(OH)2生成Ni2O3的离子方程式为_______________________amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为_______mol.
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成原电池,放电时NiO(OH)转化为Ni(OH)2,则放电时负极的电极反应式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态 Fe2+的价电子排布式为 _________,有 __________个未成对电子。
(2)氯化铝熔点为 194℃,而氧化铝熔点为 2050℃,二者熔点相差很大的原因是 _________。
(3)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如下图所示: 晶胞中 Al 的配位数是 _________,若该晶胞的边长为 a pm,则该晶体的密度为_________g·cm3。(用 N 表示阿伏加德罗常数的值)
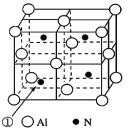
(4)一种铜的溴化物晶胞结构如下图所示:Cu 填充在 Br 的四面体空隙,则占据此类空隙的百分比为__________;该晶胞中铜的配位数是_________ ,与溴紧邻的溴原子数目是_________,由图中 P 点和 Q 点的原子坐标参数可确定 R 点的原子坐标参数为__________。
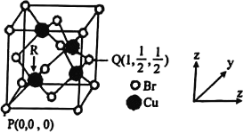
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源开发利用的部分过程如图所示。下列说法错误的是
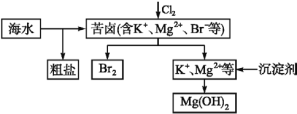
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用溶解、除杂和蒸发结晶等过程提纯
C.工业生产中常选用 NaOH 作为沉淀剂
D.制取淡水也是海水资源综合利用的一个重要方面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是工业上制备金属铝的主要原料,其主要成分是Al2O3,同时还含有SiO2 和Fe2O3。工业上可使用碱浸法提取铝土矿中的 Al2O3,其工业流程如图所示。根据图示信息,回答下列问题。
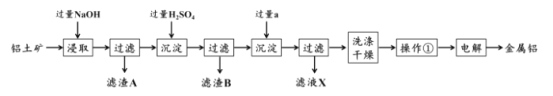
(1)为了提高铝土矿的浸取效率,可采用的方法是:______。
(2)第一次沉淀时发生了一系列离子反应,除了生成固体 B 的反应外,还有另外两个反应,请分别写出它们的离子方程式:_______,______。
(3)液体试剂 a 的化学式为_________。
(4)该工艺的副产品存在于滤液 X 中,除 Na2SO4 外,其主要成分是________ (填化学式)。试列举一项该副产品在工业生产或日常生活中的用途:________。
(5)操作①的名称为____。若在实验室中进行该操作,样品应放置在_______中。
(6)最后一步电解时往往需要加入适量冰晶石,其作用是 __________。
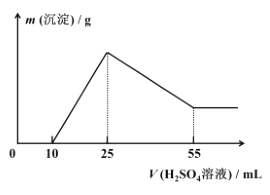
(7)取 10.0 g 铝土矿按照上述工艺进行处理,并在工艺中使用 5.0 mol/L 的稀硫酸。第一次沉淀时所得沉淀的质量与加入硫酸的体积变化关系如图所示。则该铝土矿样品中 Al2O3 的质量分数为 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com