
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。

实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
【答案】 4 NO3- 用镊子夹一块湿润的红色石蕊试纸靠近气体X,试纸变蓝 Mg(OH)2 Al(OH)3+OH-==AlO2-+2H2O 0.136 0.08
【解析】溶液无色,则不存在亚铁离子、高锰酸根离子;溶液显酸性,则不存在硅酸根离子和亚硫酸根离子;该溶液与硝酸银溶液混合后无沉淀生成,则不存在氯离子,因此一定含有硝酸根离子;该溶液与稀硫酸反应得不到沉淀,说明不存在钡离子,所得溶液与过量的氢氧化钠溶液混合生成气体X、溶液Y和沉淀Z,X是氨气,一定含有铵根离子;沉淀一定是氢氧化镁,含有镁离子;根据图像可知开始时氢氧化钠首先中和氢离子,然后沉淀金属阳离子,沉淀达到最大值后开始与铵根结合生成氨气,然后沉淀开始减少,最后不再发生变化,所以溶解的沉淀一定是氢氧化铝,含有铝离子。则
(1)根据以上分析可知不进行实验就可以推断出上表中的离子一定不存在的有4种,即亚铁离子、硅酸根离子、高锰酸根离子和亚硫酸根离子。(2)通过实验I可以确定该溶液中一定存在的阴离子是NO3-。氨气是碱性气体,检验氨气的方法是用镊子夹一块湿润的红色石蕊试纸靠近气体X,试纸变蓝;根据以上分析可知沉淀Z的化学式为Mg(OH)2。(3)实验Ⅱ的图象中BC段发生氢氧化铝的溶解,对应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。(4)A点消耗氢氧化钠6mL,则与金属阳离子反应的氢氧化钠是5mL,物质的量是0.005mol。溶解氢氧化铝消耗氢氧化钠是1mL,物质的量是0.001mol,所以生成的氢氧化铝是0.001mol,则与镁离子反应的氢氧化钠是0.002mol,氢氧化镁是0.001mol,所以对应的固体质量为0.001mol×(58+78)g/mol=0.136g。(5)与氢离子反应的氢氧化钠是1mL,物质的量是0.001mol,即氢离子是0.001mol。与铵根反应的氢氧化钠是2mL,物质的量是0.002mol,即铵根是0.002mol,根据溶液显电中性可知硝酸根的物质的量是0.001mol+0.002mol+0.001mol×3+0.001mol×2=0.008mol,所以该溶液中阴离子的浓度为0.008mol÷0.1L=0.08mol L-l。


科目:高中化学 来源: 题型:
【题目】随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。如图是某课题组设计的液体燃料电池示意图。下列有关叙述不正确的是

A. 该电池的优点是不产生污染气体,且液体燃料便于携带
B. 电池内部使用的是阴离子交换膜,OH-经交换膜移向负极
C. 该燃料电池的电极材料采用多孔纳米碳材料(如图),目的是增大接触面积,增加吸附量
D. 该电池中通入N2H4的电极为正极,发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g)2Z(g)△H=﹣a kJmolˉ1 , 一定条件下,将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.下列说法正确的是( )
A.10min内,Y的平均反应速率为0.03 molLˉ1sˉ1
B.第10min时,X的反应速率为0.01 molLˉ1minˉ1
C.10min内,消耗0.2 mol X,生成0.4 mol Z
D.10min内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的实验是
①检验自来水是否含氯离子 ②鉴别食盐和小苏打 ③蛋壳能否溶于酸 ④白酒中是否含甲醇
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是 ( )
A. 乙烯能使酸性高锰酸钾溶液褪色 B. 甲烷和氯气混合光照,黄绿色变浅
C. 将苯滴入溴水中,振荡后水层无色 D. 苯与氢气反应生成环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
反应过程中,测得不同时间H2O2的物质的量浓度如表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/molL﹣1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(1)H2O2的分解反应氧化还原反应(填“是”或“不是”).要加快该反应的速率,可采取的方法有 .
(2)该分解反应0─20min的平均反应速率v(H2O2)为molL﹣1 min﹣1 .
(3)如果反应所用的H2O2溶液为100mL,则共产生O2g.
A.0.08
B.0.16
C.1.2
D.2.4.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,涉及化学变化的是( )
A. 液氨用作制冷剂 B. 四氯化碳萃取碘水中的碘
C. 铁和铝遇到浓硝酸钝化 D. 蒸馏法将海水淡化为饮用水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
B. 足量的Fe在Cl2中燃烧生成FeCl2和FeCl3
C. 先后将等物质的量的Fe2O3和Fe分别溶于同一稀盐酸时无气体放出
D. Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3,在给定的条件下能实现转化
无水FeCl3,在给定的条件下能实现转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 还有少量Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示: 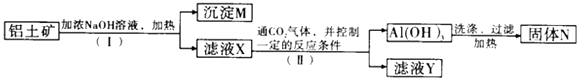
(1)Ⅰ和Ⅱ步骤中分离滤液和沉淀的操作是 .
(2)沉淀M中除含有泥沙外,一定还含有;固体N是 .
(3)滤液X中,含铝元素的溶质的化学式为;它属于(填“酸”“碱”或“盐”)类物质.
(4)实验室里常往AlCl3溶液中加入(填“氨水”或“NaOH溶液”)来制取Al(OH)3 . 发生反应的离子方程式为
(5)向滤液Y中滴加足量盐酸,发生的离子反应方程式为(若没有反应发生,则填“无”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com