
【题目】(1)浩瀚的大海蕴藏着丰富的资源,从海水中可以获得很多化学物质。海水晒盐得到___,氯碱工业的产品有氯气、___、___。
(2)以下物质中:①葡萄糖;②氧化钠;③氯化镁溶液;④液态氯化氢,其中属于电解质的是___。
(3)15.6gNa2X含有0.2molX2-,含有Na+的物质的量是___mol,Na2X的摩尔质量为___g·mol-1。
【答案】食盐 氢气 氢氧化钠 ②④ 0.4 78
【解析】
(1)海水晒盐分离出NaCl,电解饱和食盐水可生成NaOH、氢气、氯气;
(2)电解质必须为化合物,且在水溶液或熔化状态下电离出自由移动的离子;
(3)15.6gNa2X含有0.2molX2-,结合物质构成及M=![]() 计算。
计算。
(1)海水晒盐得到食盐,氯碱工业的产品有氯气、氢气、氢氧化钠;
(2)①葡萄糖为非电解质;
②氧化钠熔融可电离出离子,为电解质;
③氯化镁溶液为混合物,既不是电解质也不是非电解质;
④液态氯化氢溶于水可电离出离子,为电解质;
则属于电解质的为②④;
(3)15.6gNa2X含有0.2molX2,Na2X的物质的量为0.2mol,含有Na+的物质的量是0.2mol×2=0.4mol,Na2X的摩尔质量为![]() =78gmol1。
=78gmol1。


科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
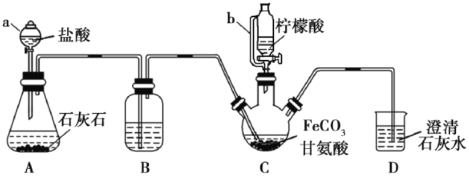
查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是________;与a相比,仪器b的优点是_______________。
(2)装置B中盛有的试剂是:____________;装置D的作用是________________。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为____________________________。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
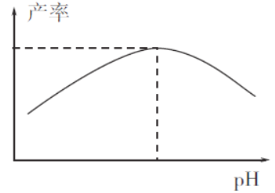
①pH过低或过高均导致产率下降,其原因是_____________________;
②柠檬酸的作用还有________________________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的分子结构也可用键线式表示为:![]() ,有机物A的键线式为
,有机物A的键线式为![]() ,A可由有机物B与等物质的量氢气通过加成反应得到。
,A可由有机物B与等物质的量氢气通过加成反应得到。
(1)有机物A的分子式为___________。
(2)有机物A的名称是_______________。
(3)在A 的主链为5个C原子的所有同分异构体中,其分子结构中含有3个甲基的有机物的名称是_______________。
(4)有机物B可能的结构简式有![]() 、_______________、_______________、_______________、_______________。
、_______________、_______________、_______________、_______________。
(5)请写出![]() 在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.8g铁粉加入50mL3mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物和还原产物的物质的量之比为2∶1
D.Fe2+和Fe3+物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是 ( )
A. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B. 所有的化学反应都需要一定的活化能来推动
C. CH3COOH 溶液加水稀释后,溶液中![]() 的值增大
的值增大
D. Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为从海带中提取碘的工业生产过程图,按照要求回答问题:

(1)海水中碘的总藏量很大,目前工业上___(填“直接”或“不直接”)用海水提取碘。
(2)工业生产过程中通常将干海带粉碎的目的是___。
(3)“滤液”中加入硫酸酸化的离子方程式是___;“氧化”步骤发生反应的离子方程式是___。
(4)生产过程图中“提纯”的方法是___。
(5)下列有关从海带中提取碘的说法错误的是___。
A.“过滤”操作若在实验室进行,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒
B.“碱化”时加入NaOH溶液的主要作用是可溶性有机质在碱性溶液中可形成沉淀
C.现在工业上从海带中提取碘时,也有用离子交换法处理含碘离子的溶液以提高碘的提取率
D.可用淀粉溶液检验“滤液”中的离子是否氧化完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列说法正确的是( )

A.PbO2是电池的负极
B.Pb是电池的负极
C.PbO2得电子,被氧化
D.电池放电时,溶液的酸性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com