
【题目】铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)滤液甲的主要成分是(写化学式___________________________________________。
(2)写出反应Ⅱ的离子方程式:______________________________________________。
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是__________(填字母)。
A.AlO![]() B.OH- C.SiO
B.OH- C.SiO![]()
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为________________________________________________________________________。
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解。
加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:____________________________________________________________________。
【答案】NaOH、NaAlO2、Na2SiO3 CO2+2OH-===CO![]() +H2O、CO2+3H2O+2AlO
+H2O、CO2+3H2O+2AlO![]() ===2Al(OH)3↓+CO
===2Al(OH)3↓+CO![]() 2- B>A>C Al(OH)3+OH-===AlO
2- B>A>C Al(OH)3+OH-===AlO![]() +2H2O H++OH-===H2O;AlO
+2H2O H++OH-===H2O;AlO![]() +H++H2O===Al(OH)3↓;Al(OH)3+3H+===Al3++3H2O
+H++H2O===Al(OH)3↓;Al(OH)3+3H+===Al3++3H2O
【解析】
由制备流程可知,I中Al2O3、SiO2与NaOH反应,而Fe2O3不与NaOH反应,则沉淀为Fe2O3;I发生Al2O3+2NaOH+3H2O═2Na〔Al(OH)4〕、SiO2+2NaOH═Na2SiO3+H2O,滤液甲中含NaOH、NaAlO2、Na2SiO3,再通入二氧化碳发生2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-;最后氢氧化铝受热分解生成氧化铝与水;
(1)由上述分析可知,滤液甲中含NaOH、NaAlO2、Na2SiO3;
(2)由流程可知,反应Ⅱ的离子方程式为CO2+2OH-═CO32-+2H2O、2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-;
(3)碱性越强,结合质子(H+)的能力越强,则结合质子(H+)的能力为B>A>C;
(4)滤液甲少许,加入过量盐酸,过滤,得到滤液中含NaCl、AlCl3,再用惰性电极电解其滤液,生成NaOH和氢气、氯气,在阴极区还有沉淀生成,最后沉淀消失,沉淀消失发生Al(OH)3+OH-=AlO2-+2H2O;
(5)该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100molL-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解,则溶质为NaOH、NaAlO2;加入50.0mL 盐酸溶液发生的离子反应的先后顺序依次为H++OH-═H2O、H++AlO2-+H2O═Al(OH)3↓、Al(OH)3+3H+═Al3++3H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
(1)加热,放出的气体可以使品红溶液褪色;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是![]()
![]()
![]()
A.SO42-B.Br-C.H2SO3D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。
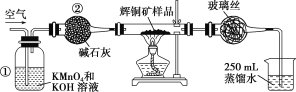
实验原理:Cu2S+O2![]() SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000 g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1 L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为Cu2S+O2![]() SO2+2Cu。
SO2+2Cu。
F.移取25.00 mL含SO2的水溶液于250 mL锥形瓶中,用0.010 0 mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2~3次。
试回答下列问题:
(1)装置①的作用是______________;装置②的作用是____________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为___。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是____________(写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H—Cl键的键能是431kJ/mol,Cl—Cl键的键能是247 kJ /mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJB.179kJC.89.5kJD.以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn+CuSO4=ZnSO4+Cu。
①画出装置图:___。
②电极材料和电解质溶液各是什么___。?
③写出电极反应式:负极:___;正极:___。
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气___L(标准状况下)。导线中通过___mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )

A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
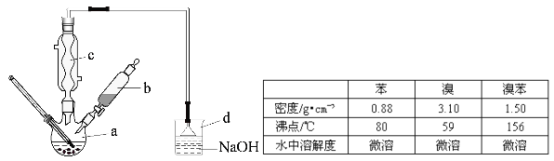
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学—有机化学基础)瘦肉精又名克伦特罗(4-氨基-α-叔丁胺甲基-3,5-二氯苯甲醇),是一种β2肾上腺素受体激动剂,临床上用于治疗哮喘。可由下图所示路线合成:

其中X表示某中间物质,请回答下列问题。
(1)判断反应④的反应类型 。
(2)书写反应③所代表的化学反应方程式:
。
(3)试推断中间物质X的结构简式: 。
(4)对氨基苯乙酮![]() 的同分异构体有多种,请写出符合以下条件的其中任意一种
的同分异构体有多种,请写出符合以下条件的其中任意一种
a.苯环与氨基相连 b.与新制的Cu(OH)2悬浊液加热,有红色物质生成
c.苯环上有2个取代基
(5)①②③代表的整个反应过程完成了苯胺对位的酰基化,也完成了对 (填官能团名称)的保护,同时也避免了一些副反应的发生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com