
【题目】(1)选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn+CuSO4=ZnSO4+Cu。
①画出装置图:___。
②电极材料和电解质溶液各是什么___。?
③写出电极反应式:负极:___;正极:___。
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气___L(标准状况下)。导线中通过___mol电子。
【答案】 负极:锌片、正极:铜片;CuSO4溶液 Zn–2e-=Zn2+ Cu2++2e-=Cu 1.12L 0.1
负极:锌片、正极:铜片;CuSO4溶液 Zn–2e-=Zn2+ Cu2++2e-=Cu 1.12L 0.1
【解析】
(1)利用反应Zn+CuSO4=ZnSO4+Cu设计原电池,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如铜等,也可以是碳棒,电解质溶液应为CuSO4,根据原电池原理写出电极反应式。(2)根据锌和氢气之间转移电子数目相等计算。
(1)①利用反应Zn+CuSO4=ZnSO4+Cu设计原电池,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如铜等,也可以是碳棒,电解质溶液应为CuSO4,设计的原电池装置为: ;
;
②根据以上设计可知,负极为锌片,正极为铜片,电解质溶液为CuSO4溶液;
③原电池中负极活泼金属失电子发生氧化反应,电极反应为:Zn–2e-=Zn2+,正极为溶液中的阳离子得到电子发生还原反应,CuSO4溶液中的阳离子有Cu2+和H+,放电能力Cu2+大于H+,正极反应为:,Cu2++2e-=Cu;
(2)用锌片、铜片连接后浸入稀硫酸溶液中构成的原电池中,负极:Zn–2e-=Zn2+,正极:2H++2e-=H2↑,由电极反应n(H2)=n(Zn)=![]() ,V(H2)=0.05mol22.4L/mol=1.12L,n(e-)=2 n(Zn)=20.05mol=0.1mol。
,V(H2)=0.05mol22.4L/mol=1.12L,n(e-)=2 n(Zn)=20.05mol=0.1mol。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应。其中D为纯净干燥的氯气与纯净干燥氨气反应的装置。

请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是_____________。
(2)装置E的作用是___,橡胶管k的作用是___________________。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是_________。
(4)装置F中试管内发生反应的化学方程式_______________。
(5)接入D装置的两根导管左边较长、右边较短,目的是__________.
(6)整套装置从左向右的连接顺序是(j)接(___)(___)接(f)(g)接(___)(___)接(___)(___)接(a)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A______B______C______D______
(2)D元素位于周期表中第______周期第______族.C2B2的电子式:_________,所含化学键类型______________。
(3)AB2的电子式:___________写出AB2与C2B2反应的化学方程式____________________。
(4)画出B的原子结构示意图_____________。
(5)用电子式表示化合物C2D的形成过程:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
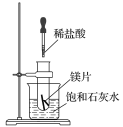
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电子式表示H2O和MgBr2的形成过程:___、___。
(2)H2O以___键结合,MgBr2以___键结合。(填极性键、非极性键、离子键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)滤液甲的主要成分是(写化学式___________________________________________。
(2)写出反应Ⅱ的离子方程式:______________________________________________。
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是__________(填字母)。
A.AlO![]() B.OH- C.SiO
B.OH- C.SiO![]()
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为________________________________________________________________________。
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解。
加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgBr比AgCl更难溶,将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,发生的反应为
A. 只有AgBr沉淀生成 B. AgCl与AgBr沉淀等量生成
C. AgCl与AgBr沉淀都有,但以AgCl沉淀为主 D. AgCl与AgBr沉淀都有,但以AgBr沉淀为主
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如下表。下列有关说法不正确的是
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 7.5 | 11.6 | 9.7 | 8.3 |
A. 同温度同浓度下,酸性由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数约为9×10-13
HF+OH-的平衡常数约为9×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:c(CO32-)+c(HCO3-)+ c(H2CO3)=0.2mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> >c (H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能由Ba(OH)2、NaOH、Na2CO3、KCl、K2SO4中的几种物质混合而成。取适量样品进行如下实验(假设各反应物都充分反应),根据实验现象和实验数据,下列说法不正确的是( )

A.沉淀甲中有1.97gBaCO3
B.固体混合物X中一定有Ba(OH)2、Na2CO3、K2SO4
C.根据上述实验现象无法确定固体混合物X中是否有NaOH
D.用铂丝蘸取溶液甲在酒精灯火焰上灼烧,通过蓝色钴玻璃观察焰色,即可判断X中有无KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com