
课本介绍了乙醇催化氧化的实验。
(1)甲同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是①试剂: ②现象 。
③方程式 (用课本所学的知识回答)
(2)甲同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
Ⅰ.①溴与乙醛发生取代反应;② ③由于醛基具有还原性,溴将乙醛氧化为乙酸。请将猜想②填写完全。
Ⅱ.为探究哪种猜想正确,甲同学提出了如下两种实验方案:
方案一:用广泛pH试纸检测溴水褪色后溶液的酸碱性;
这种方法是否能判断出具体的反应原理 (填能或否)
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 离子的物质的量。
甲同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后
n(Br—)= mol,则说明溴与乙醛发生取代反应。
(1)①银氨溶液/新制氢氧化铜悬浊液(2分)
②出现银镜/出现红色沉淀(2分)
③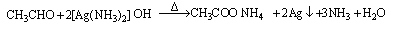 (2分)
(2分)
或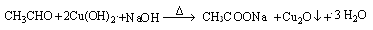
(2)Ⅰ.溴与乙醛发生加成反应 (2分) Ⅱ. 否(2分) a (2分)
【解析】
试题分析:(1)①乙醇催化氧化后的产物是乙醛,验证乙醛的存在需用银氨溶液或新制氢氧化铜悬浊液,②对应现象是出现银镜或有红色沉淀出现,③相应化学方程式为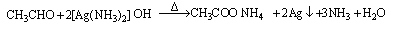
或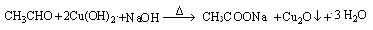
(2)Ⅰ因为乙醛分子中有碳氧双键,猜想可能发生加成反应 ; Ⅱ 因为乙醛与溴发生取代反应后的产物中有溴化氢生成,使溶液显酸性;乙醛被溴氧化后生成乙酸,溶液也显酸性,所以用广泛pH试纸检测溴水褪色后溶液的酸碱性,不能判断出具体的反应原理,填“否”;若溴离子的物质的量为0,说明发生加成反应,若为2amol,则说明发生氧化反应,若为amol则发生取代反应,填“a”。
考点:考查乙醇的催化氧化、乙醛的化学性质、方程式的书写、醛基的检验、反应类型的分析


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:选择题
用铂电极电解某金属的氯化物(MCl2)溶液,当阳极上收集到1.12 L Cl2时(标准状况),阴极增重3. 2g.下列有关叙述正确的是
A.M的相对原子质量为32
B.电解过程中溶液的pH不发生变化
C.M的相对原子质量为64
D. 电路中通过0.5mol电子
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二教学评估(一)化学试卷(解析版) 题型:选择题
下列数据是有机物的相对分子质量,可能互为同系物的一组是
A.16、30、58、72 B.16、28、40、52
C.16、32、48、54 D.16、30、42、56
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.乙烷和乙烯均可使酸性KMnO4溶液褪色
B.纤维素、淀粉和蛋白质都是高分子化合物
C.煤的干馏和石油的分馏均属化学变化
D.酯类和糖类均能发生水解反应
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:选择题
背景材料:①2009年夏季,特氟隆不粘锅事件引起公众关注;②2009年冬季,诺贝尔化学奖授予研究蛋白质的科学家;③2011年初春,广东大部分地区进行了人工降雨;④2012年春末,某高速公路发生液氯运输车翻倒泄漏事故。下列相应说法正确的是
A.特氟隆(聚四氟乙烯)的单体是氟利昂(CCl2F2)
B.蛋白质是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔现象
C.附近人员应迅速远离液氯泄漏地点,并顺风方向疏散
D.AgI和干冰都可用于人工降雨
查看答案和解析>>
科目:高中化学 来源:2015届北京市怀柔区高二上学期期末质量检测化学试卷(解析版) 题型:选择题
下列关系正确的是( )
A.熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷
B.密度:CCl4>H2O>苯
C.同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷
D.同物质的量物质燃烧耗O2量:己烷>环己烷>苯>苯甲酸
查看答案和解析>>
科目:高中化学 来源:2015届北京市怀柔区高二上学期期末质量检测化学试卷(解析版) 题型:选择题
下列物质中主要成分是天然高分子化合物的是
A.脂肪 B.棉花 C.蔗糖 D.聚乙烯
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:填空题
乙醇的生产过程可由下图表示:
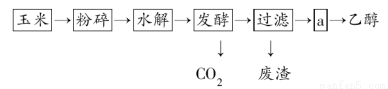
(1)粉碎玉米的目的是___________________________。
(2)生产过程中为了检验淀粉是否完全水解,可使用的试剂是________。
(3)步骤a的操作是( )
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:
______________________________________________。
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+nH2O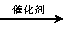 nC6H12O6
nC6H12O6
C6H12O6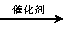 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
根据上述反应式,可以算出100kg淀粉理论上可生产无水乙醇________kg。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
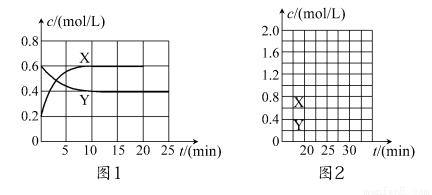
请回答:
(1)图l中,曲线________(填“X”或“Y”)表示NO2浓度随时间的变化情况;前10 min内v(NO2)=________mol/(L·min)。
(2)下列选项中不能说明该反应已达到平衡状态的是________(填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而变化
(3)反应进行到10 min时,共吸收热量22.76 kJ,则该反应的热化学方程式为_________________________________;该反应的平衡常数K=________。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为ω1,达到新平衡后混合气体中NO2的体积分数为ω2,则ω1________ω2(填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com