



科目:高中化学 来源: 题型:
| A、某化合物溶于水导电,则该化合物为电解质 |
| B、NaCl溶液在电流作用下电离成Na+和Cl- |
| C、在氧化还原反应中,非金属单质一定是氧化剂 |
| D、元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
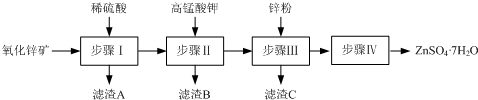
查看答案和解析>>
科目:高中化学 来源: 题型:
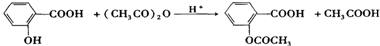
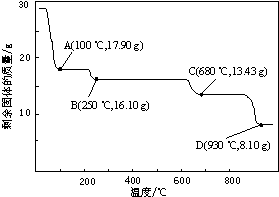
查看答案和解析>>
科目:高中化学 来源: 题型:
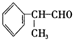 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下: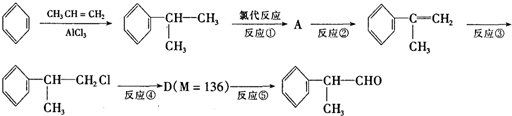
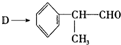 反应的化学方程式为
反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液 |
| B、NaOH溶液 |
| C、NH4Cl溶液 |
| D、NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl在饱和NaCl溶液中的 KSP比在纯水中的 KSP 小 |
| B、向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP (AgCl)<KSP (AgI) |
| C、将0.001 mol?L-1 的AgNO3溶液滴入0.001 mol?L-1 的KCl和0.001 mol?L-1 的K2CrO4 溶液中先产生Ag2CrO4沉淀 |
| D、向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含Fe2+ |
| B、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C、向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42- |
| D、常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com