
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解错误的是( )
A | B | C | D | |
中华 文化 | “千淘万漉虽辛苦,吹尽狂沙始到金”--刘禹锡《浪涛沙》 | 《天工开物》锤锻篇(冶铁)记载:“谚云,‘万器以钳为祖。’非无稽之说也。” | 成语“刀耕火耨(nòu)” |
侯德榜 |
从化学 的视角 理解 | 诗句中的“淘、漉”相当于分离提纯操作中的“过滤” | “钳”是指作为熔铁炉、加热炉的坩埚 | 古人播种前先伐去树木烧掉野草,用余灰可以肥田,还可以降低土壤碱性 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是纯碱 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】五氧化二钒在工业生产中有重要用途。某含钒废料的成分为V2O5、V2O4、SiO2、Fe2O3、Al2O3,实验小组从其中回收V2O5的一种工艺流程如下:
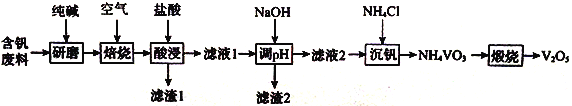
请回答下列问题;
(1)(研磨)的目的为__________________。所加纯碱不宜过量太多,理由为_________。
(2)“焙烧”后所得混合物中除含Na2CO3、NaVO3、Fe2O3、NaA1O2外,还含有________(填化学式)。
(3)“酸浸”时,VO3-转化为VO2+,转化反应的离子方程式为_________________________;滤渣1的主要成分为_________________(填化学式)。
(4)已知:常温下,Al(OH)3、Fe(OH)3 饱和溶液中金属阳离子浓度的负对数[-lg c(M3+ )]与pH 的关系如图所示:
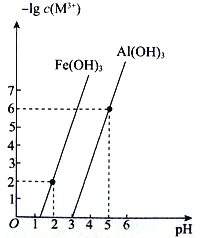
常温下,Ksp[Fe(OH)3]=________________________;当调pH=4 时,溶液中A13+________(填“是”或“否”)沉淀完全。(已知;溶液中离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全)
(5)“煅烧”时,反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、请用勒·夏特列原理解释如下生活中的常见现象:打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。_______________________________________________________________
II、一密封体系中发生下列反应:N2 +3H2 ![]() 2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:

回答下列问题:
(1)处于平衡状态的时间段是_______________________
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?____________、 ____________、____________
(3)下列各时间段时,氨的百分含量最高的是(______)
A、t0~t1 B、t2~t3 C、t3~t4 D、t5~t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1的无色透明溶液中不能大量共存的离子组是( )
A.Al3+、Ag+、NO3、﹣Cl﹣
B.Mg2+、NH4+、NO3﹣、Cl﹣
C.Ba2+、K+、S2、﹣Cl﹣
D.Zn2+、Na+、NO3﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了一个“黑笔红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
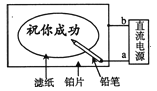
A. 铅笔芯作阳极,发生还原反应
B. 铂片端作阴极,发生氧化反应
C. 铅笔端附近有少量的氯气产生
D. 红字是H+放电,c(OH-)增大造成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法不正确的是
A.1 mol醋酸的质量与NA个醋酸分子的质量相等
B.NA个氧气分子和NA个氢气分子的质量比等于16∶1
C.30 g乙烷(C2H6)所含的原子数目为NA
D.在标准状况下, 0.5NA个氯气分子所占体积约是11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)-c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确确是
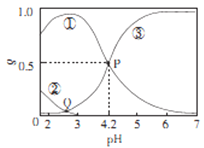
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol/L的NaHC204溶液中:c(OH-)=c(H+)-2c(C2042-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
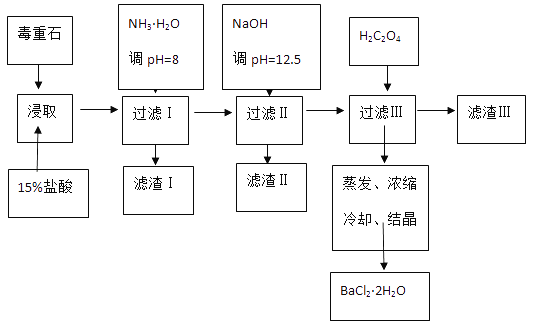
(1)实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的_________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_______(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是___________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
向BaC2O4悬浊液中加入CaCl2,可发生沉淀的部分转化,请写出反应过程中的离子方程式___________________,计算该反应的平衡常数K=___________(Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,保留一位小数)
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移动x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。根据上述数据,可计算出BaCl2溶液浓度为_________molL-1(用含字母的式子表示)。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将_______(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s) + CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
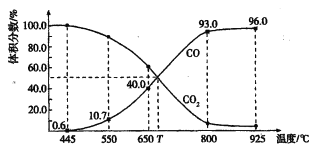
已知:气体分压(P分)=气体总压(p总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,V正、V逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为40.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com