
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s) + CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
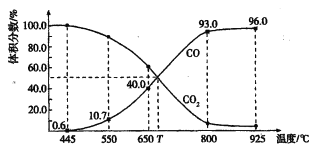
已知:气体分压(P分)=气体总压(p总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,V正、V逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为40.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
【答案】D
【解析】A,550℃,若充入惰性气体,容器的压强不变,容器的体积增大,相当于减小压强,υ正、υ逆均减小,平衡向正反应方向移动,A项错误;B,由图知650℃时,CO的体积分数为40%,CO2的体积分数为60%,平衡时n(CO2):n(CO)=60%:40%=3:2,设CO2平衡物质的量为3mol,CO平衡物质的量为2mol,生成2molCO消耗1molCO2,反应达到平衡时CO2的转化率为![]() 100%=25%,B项错误;C,T℃平衡时CO与CO2的体积分数相等,若充入等体积的CO2和CO即为平衡状态,平衡不移动,C项错误;D,925℃时CO的体积分数为96%,CO2的体积分数为4%,CO的分压为0.96p总,CO2的分压为0.04p总,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(0.96p总)2
100%=25%,B项错误;C,T℃平衡时CO与CO2的体积分数相等,若充入等体积的CO2和CO即为平衡状态,平衡不移动,C项错误;D,925℃时CO的体积分数为96%,CO2的体积分数为4%,CO的分压为0.96p总,CO2的分压为0.04p总,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(0.96p总)2![]() (0.04p总)=23.04p总;答案选D。
(0.04p总)=23.04p总;答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解错误的是( )
A | B | C | D | |
中华 文化 | “千淘万漉虽辛苦,吹尽狂沙始到金”--刘禹锡《浪涛沙》 | 《天工开物》锤锻篇(冶铁)记载:“谚云,‘万器以钳为祖。’非无稽之说也。” | 成语“刀耕火耨(nòu)” |
侯德榜 |
从化学 的视角 理解 | 诗句中的“淘、漉”相当于分离提纯操作中的“过滤” | “钳”是指作为熔铁炉、加热炉的坩埚 | 古人播种前先伐去树木烧掉野草,用余灰可以肥田,还可以降低土壤碱性 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是纯碱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2b kJ·mol﹣1
B.C2H2(g)+![]() O2(g)═2CO2(g)+H2O(l)△H=+2b kJ·mol﹣1
O2(g)═2CO2(g)+H2O(l)△H=+2b kJ·mol﹣1
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4b kJ·mol﹣1
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,一个充满Cl2的恒容密闭容器的质量为74.6 g,若改充满N2,其质量为66 g,则容器的容积为:
A.5.6LB.11.2LC.2.24LD.4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol﹣1,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H= kJ·mol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”,下同)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣,请写出该反应的负极反应式 ;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH-)= mol/L(假设溶液的体积不变,气体全部从溶液中逸出).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
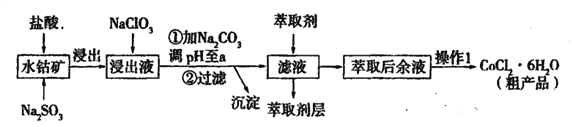
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室需配制100mL2 mol/LNaOH溶液,请回答下列问题
(1)配制过程中不需要使用的化学仪器有_______(填选项的字母)。
A.烧杯. B.100mL容量瓶 C.漏斗 D.胶头滴管 E.玻璃棒
(2)用托盘天平称取所需氢氧化钠固体,质量为______g。
Ⅱ.某校化学兴趣小组利用右图装置来制取氨气
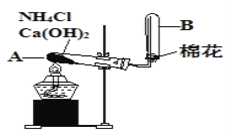
(1)写出用此方法制NH3的化学反应方程式___________________。
(2)图中收集氨气的方法为___________。
(3)若将有浓盐酸的玻璃棒靠近收集氨气的导管口,能观察到的实验现象为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl、SO42—、NH4+、CO32—、K+、Na+。为确认溶液组成进行如下实验:
①200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。
(1)溶液一定存在的离子有____,可能存在的离子有______;
(2)原溶液中c(CO32—)为____,c(NH4+)____c(SO42—) (填“>、<或=”);
(3)如果上述6种离子都存在,则c(Cl)__c(SO42—) (填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是( )
A. 热稳定性:Na2CO3>NaHCO3 B. 酸性:H2CO3>H2SiO3
C. 碱性:NaOH>LiOH D. 热稳定性:HF>HBr
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com