
����Ŀ��I.ʵ����������100mL2 mol/LNaOH��Һ����ش���������
��1�����ƹ����в���Ҫʹ�õĻ�ѧ������_______����ѡ�����ĸ����
A.�ձ�. B.100mL����ƿ C.©�� D.��ͷ�ι� E.������
��2����������ƽ��ȡ�����������ƹ���������Ϊ______g��
��.ijУ��ѧ��ȤС��������ͼװ������ȡ����
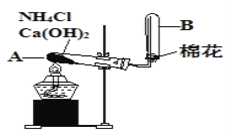
��1��д���ô˷�����NH3�Ļ�ѧ��Ӧ����ʽ___________________��
��2��ͼ���ռ������ķ���Ϊ___________��
��3��������Ũ����IJ����������ռ������ĵ��ܿ����ܹ۲쵽��ʵ������Ϊ___________��
���𰸡� C 8.0 2NH4Cl��Ca(OH)2![]() CaCl2��2H2O��2NH3�� �����ſ����� ���ְ���
CaCl2��2H2O��2NH3�� �����ſ����� ���ְ���
��������������������⿼�����ʵ���Ũ����Һ�����ƣ�������ʵ�����Ʊ���
I.��1���ɹ����������ʵ���Ũ����Һ��ʵ�鲽��Ϊ��������������ܽ����ȴ��ת�ơ�ϴ�ӡ����������ݡ�ҡ�ȡ�װƿ����ǩ����Ҫ�������У���ƽ��ҩ�ס��ձ�����������100mL����ƿ����ͷ�ι�������Ҫ��������©������ѡC��
��2����������ƽ������m��NaOH��=2mol/L![]() 0.1L
0.1L![]() 40g/mol=8.0g��
40g/mol=8.0g��
II.��1��NH4Cl��Ca��OH��2�����Ϲ��ȷ�Ӧ����CaCl2��NH3��H2O����Ӧ�Ļ�ѧ����ʽΪ2NH4Cl+Ca��OH��2![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
��2��NH3��������ˮ��NH3���ܶȱȿ���С��ͼ���ռ�NH3�ķ���Ϊ�����ſ�������
��3��Ũ����ӷ�������HCl��NH3���ϳ�NH4Cl��NH4Cl�ǰ�ɫ���壬�����ܹ۲쵽��ʵ������Ϊ���ְ��̡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20��ʱ,��H2C2O4��NaOH�����Һ�У�c(H2C2O4)-c(HC2O4-)+c(C2O42-)=0.100mol/L����̼Ԫ�����ķֲ�����������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷȷ��
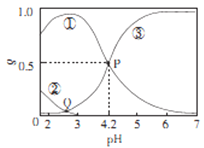
A. �ٱ�ʾH2C2O4�ķֲ����ߣ��۱�ʾC2O42-�ķֲ�����
B. 20��ʱ��H2C2O4�Ķ�������ƽ�ⳣ��Ka=1��10-4.2
C. Q���Ӧ��Һ��lgc(H+)<lgc(OH-)
D. 0.100mol/L��NaHC204��Һ��:c(OH-)=c(H+)-2c(C2042-)+c(H2C2O4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ����������ȷ����
A | B | C | D | |
ǿ����� | Cu(OH)2 | KCl | HCl | CaCO3 |
������� | NaOH | NH3H2O | BaSO4 | CH3COOH |
�ǵ���� | SO2 | ���ʯ | NH3 | C2H5OH |
�������� | ʯī | ϡH2SO4 | ����KCl | ͭ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��C(s) + CO2��g��![]() 2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
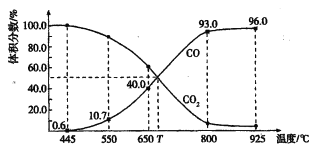
��֪�������ѹ��P����=������ѹ��p�������������������˵����ȷ����
A. 550��ʱ��������������壬V����V������С��ƽ�ⲻ�ƶ�
B. 650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ40.0%
C. T��ʱ��������������CO2��CO��ƽ�����淴Ӧ�����ƶ�
D. 925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp= 23. 04p��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����顢��ϩ�����ֳ������л���������Ϊ�������������ɽ����Ƿֱ�ͨ��__________________������������������Һ���������Ը��������Һ������ϡ����"����
��2���Ҵ������������������ֳ����л���,�Ҵ��Ĺ�����������_____________���Ҵ���������Ũ�����������ͼ��ȵ������·�����Ӧ,����_________��д�ṹ��ʽ����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA������˵����ȷ���ǣ� ��
A. �ö��Ե缫���1 L 1mol/L CuSO4��Һ�������õ���ͭԭ�ӵ���Ŀһ��ΪNA
B. ��2.3g��Ͷ�뵽100ml 0.8mol/L��ϡ�����У���ȫ��Ӧ��ɵõ�H2����ĿΪ0.01NA
C. 1molCl2����ˮ����Һ��Cl2��HClO��ClO����Cl��������������Ϊ2NA
D. ��״���£�2molNa2O2��44.8LSO2��ȫ��Ӧ��ת�Ƶĵ�����ĿΪ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ľ�֪ʶ�������������������⣬���漰����ѧ�仯���ǣ� ��
A.ʳ�︯�ܱ���
B.Ũ�����ڿ������������
C.�������γ����ܵı�Ĥ
D.ʳ��ϴ��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L���ܱ�������ͨ��2molNH3����һ���¶��·������з�Ӧ��2NH3![]() N2+3H2���ﵽƽ��ʱ��������N2�İٷֺ���Ϊa%����ά��������������¶ȶ����䣬�ֱ�ͨ�����г�ʼ���ʣ��ﵽƽ��ʱ��������N2�İٷֺ���ҲΪa�����ǣ� ��
N2+3H2���ﵽƽ��ʱ��������N2�İٷֺ���Ϊa%����ά��������������¶ȶ����䣬�ֱ�ͨ�����г�ʼ���ʣ��ﵽƽ��ʱ��������N2�İٷֺ���ҲΪa�����ǣ� ��
A. 3molH2+2molN2 B. 2molNH3��1molN2
C. 2molH2+3molN2 D. 0.1molNH3��0.95molN2+2.85molH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�û���ʵ�뽺�������û�й�ϵ���ǣ� ��
A.��������������ˮ
B.���Ȼ�����Һ�еμ�NaOH��Һ���ֺ��ɫ����
C.�峿�������ï�ܵ����ֲ��������Ĺ���
D.��ʯ�����±���ƶ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com