
【题目】在标准状况下,一个充满Cl2的恒容密闭容器的质量为74.6 g,若改充满N2,其质量为66 g,则容器的容积为:
A.5.6LB.11.2LC.2.24LD.4.48L
科目:高中化学 来源: 题型:
【题目】在pH=1的无色透明溶液中不能大量共存的离子组是( )
A.Al3+、Ag+、NO3、﹣Cl﹣
B.Mg2+、NH4+、NO3﹣、Cl﹣
C.Ba2+、K+、S2、﹣Cl﹣
D.Zn2+、Na+、NO3﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
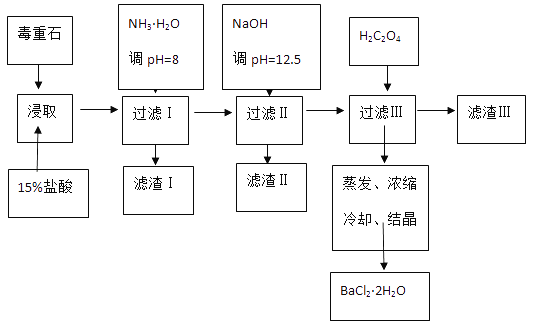
(1)实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的_________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_______(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是___________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
向BaC2O4悬浊液中加入CaCl2,可发生沉淀的部分转化,请写出反应过程中的离子方程式___________________,计算该反应的平衡常数K=___________(Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,保留一位小数)
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移动x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。根据上述数据,可计算出BaCl2溶液浓度为_________molL-1(用含字母的式子表示)。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将_______(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500℃时,把0.3mol SO2和0.2mol O2充入一个体积为10L并盛有V2O5(催化剂)的真空密闭容器中,保持温度不变,经2min后,容器内的压强不再变化,此时容器内压强减小20%。下列说法正确的是( )
A.该温度下此反应的平衡常数K=400
B.其他条件不变,再充入0.3mol SO2和0.2mol O2平衡时,SO2的体积分数增大
C.平衡时,SO2的转化率为95%
D.前2min SO2的平均反应速率0.02mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合中正确的是
A | B | C | D | |
强电解质 | Cu(OH)2 | KCl | HCl | CaCO3 |
弱电解质 | NaOH | NH3H2O | BaSO4 | CH3COOH |
非电解质 | SO2 | 金刚石 | NH3 | C2H5OH |
导电物质 | 石墨 | 稀H2SO4 | 熔融KCl | 铜 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种锂铜可充电电池,工作原理如图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法不正确的是
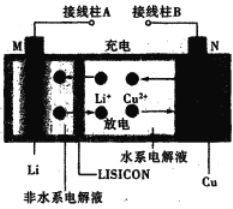
A. 陶瓷片允许Li+通过,不允许水分子通过
B. 放电时,N为电池的正极
C. 充电时,阴极反应为:Li+ +e-=Li
D. 充电时,接线柱A应与外接电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s) + CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
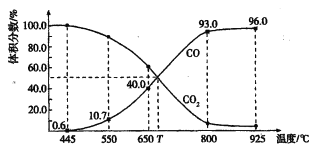
已知:气体分压(P分)=气体总压(p总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,V正、V逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为40.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A. 用惰性电极电解1 L 1mol/L CuSO4溶液,阴极得到的铜原子的数目一定为NA
B. 将2.3g钠投入到100ml 0.8mol/L的稀盐酸中,完全反应后可得到H2的数目为0.01NA
C. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰铵晶体可用作织物和木材加工的防火剂等。由二氧化锰等作原料制取硫酸锰铵晶体步骤如下:
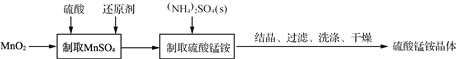
(1)实验前,需称量MnO2的质量,这是因为____________________________。
(2) “制取MnSO4”时,可用C6H12O6(葡萄糖)、H2C2O4(草酸)等物质作还原剂。
①用C6H12O6作还原剂(被氧化为CO2)时,发生反应的n(MnO2)/n(C6H12O6)=________。
②用H2C2O4作还原剂,发生反应的化学方程式为____________________________。
(3)一种测定硫酸锰铵晶体[设为: (NH4)xMny(SO4)z·wH2O]组成的方法如下:
①称取一定量的硫酸锰铵晶体配成250 mL溶液A。
②取25.00 mL溶液A加入足量的BaCl2溶液得BaSO4 0.512 6 g。
③另取25.00 mL溶液A加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min[4NH![]() +6HCHO===3H++6H2O+(CH2)6N4H+,滴定时,1 mol(CH2)6N4H+与1 mol H+相当],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH标准溶液滴定至终点(在该过程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
+6HCHO===3H++6H2O+(CH2)6N4H+,滴定时,1 mol(CH2)6N4H+与1 mol H+相当],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH标准溶液滴定至终点(在该过程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
④取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在371 ℃时已完全失去结晶水)。根据以上实验数据计算确定硫酸锰铵晶体的化学式(写出计算过程)。__________________
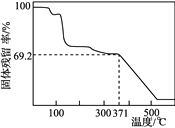
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com