
【题目】下列说法正确的是( )
A.直径介于1nm~100nm之间的微粒称为悬浊液
B.制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸
C.胶体与浊液的本质区别是其稳定性,胶体属于介稳体系
D.利用丁达尔效应可以区分溶液和胶体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A. 绿色荧光蛋白质(GFP)是高分子化合物,不可降解,其水溶液有丁达尔效应
B. 五彩缤纷的北京奥运会焰火利用了“焰色反应”原理
C. 三聚氰胺分子结构如图所示 ,分子式是C3H6N6
,分子式是C3H6N6
D. 氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2 ↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号);H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(2)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO4-+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4____mL,配制中需要用到的主要玻璃仪器是(填序号)______。A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是______________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
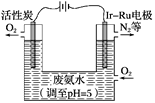
①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH4+)________(填“>”“<”或“=”)c(NO3-)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为:______________________。
③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,下列说法不正确的是( )

A. 装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B. 甲、乙装置中的能量变化均为化学能转化为电能
C. 装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D. 装置乙中负极的电极反应式:Zn-2e-===Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在饮用水中添加含钙、镁、锌、硒等的矿物质,可以改善人体营养,增强体质。其中的“钙、镁、锌、硒”是指
A. 元素 B. 原子 C. 离子 D. 核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强碱性的无色透明溶液中,能大量共存的离子组是( )
A.K+、Na+、SO42-、CO32-B.Mg2+、NH4+、NO3-、Cl-
C.Ba2+、K+、Cu2+、Cl-D.Na+、Ag+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
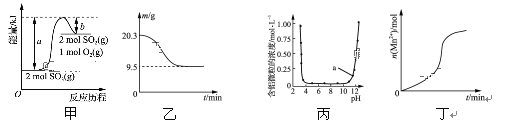
A. 由图甲可知,2SO3(g)![]() 2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1
2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1
B. 图乙表示0.1 mol MgCl2·6H2O在空气中充分加热时残留固体质量随时间的变化
C. 图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中存在大量Al3+
D. 图丁表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1的H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对反应有催化作用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:

(1)化合物C中含氧官能团的名称为________、________。
(2)D→E的反应类型为________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:____________________。
①不能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
(4)化合物B的分子式为C10H14O,写出B的结构简式:________________。
(5)已知: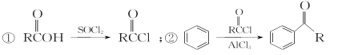 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备![]() ,写出相应的合成路线流程图________________ (无机试剂任用,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图________________ (无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:
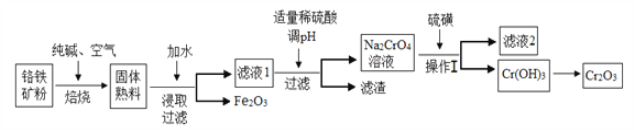
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,该步骤不能使用陶瓷容器,原因是____________________________________。
8Na2CrO4+2Fe2O3+8CO2,该步骤不能使用陶瓷容器,原因是____________________________________。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:___________________________。
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为________________________。滤渣中除Al(OH)3外还有__________(填化学式)。
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为______%。
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______,才能使铬离子沉淀完全。(已知溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Cr(OH)3的溶度积常数为1.0×10-32。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com