
【题目】氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:
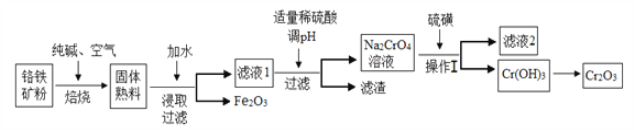
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,该步骤不能使用陶瓷容器,原因是____________________________________。
8Na2CrO4+2Fe2O3+8CO2,该步骤不能使用陶瓷容器,原因是____________________________________。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:___________________________。
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为________________________。滤渣中除Al(OH)3外还有__________(填化学式)。
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为______%。
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______,才能使铬离子沉淀完全。(已知溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Cr(OH)3的溶度积常数为1.0×10-32。)
【答案】 +3 陶瓷在高温下会与Na2CO3反应 将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次 4CrO42+6S+7H2O=4Cr(OH)3↓+3S2O32+2OH H2SiO3 75.0 5.0
【解析】(1)根据元素化合价代数和为零的原则计算;(2)陶瓷的成分之一高温下能够与碳酸钠反应;(3)掌握如何过滤、洗涤等操作的步骤;(4)在硫磺与铬酸钠的反应中生成物是硫代硫酸钠,根据离子反应的特点和离子方程式书写要求写出离子反应方程式;(5)根据Cr元素守恒计算理论上生成的Cr2O3的质量,确定产率;(6)根据溶度积常数进行计算。
(1)亚铬酸亚铁[Fe(CrO2)2]中Fe元素化合价是+2价,O元素化合价-2价,根据化合价代数和为零的原则进行计算,Cr的化合价是+3价,正确答案:+3价;
(2)陶瓷的主要成分是硅酸盐,其成分中的SiO2与Na2CO3在高温下能够发生反应,SiO2+Na2CO3![]() Na2SiO3+CO2↑,所以在焙烧时不能使用陶瓷容器,正确答案:陶瓷在高温下会与Na2CO3反应;
Na2SiO3+CO2↑,所以在焙烧时不能使用陶瓷容器,正确答案:陶瓷在高温下会与Na2CO3反应;
(3)洗涤沉淀的操作是:将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次,正确答案:将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次;
(4)硫磺与铬酸钠的反应生成硫代硫酸钠,同时生成氢氧化钠和氢氧化铬沉淀,反应的离子方程式:4CrO42+6S+7H2O=4Cr(OH)3↓+3S2O32+2OH;在焙烧时Al2O3和SiO2分别与碳酸钠在高温下生成NaAlO2和Na2SiO3,NaAlO2和Na2SiO3在酸性条件下生成Al(OH)3和H2SiO3沉淀,所以滤渣中除Al(OH)3外还有H2SiO3沉淀,正确答案:4CrO42+6S+7H2O=4Cr(OH)3↓+3S2O32+2OH;H2SiO3;
(5)铬铁矿粉中含Fe(CrO2)2的质量:m[Fe(CrO2)2]=448Kg×80%=358.4Kg,根据Cr元素守恒,理论上得到的Cr2O3:n(Cr2O3)=358.4Kg×103÷224g/mol=1.6×103mol;m(Cr2O3)=1.6×103mol×152g/mol=2.432×105g=243.2Kg,所以生成Cr2O3的产率:182.4 kg/ 243.2Kg×100%=75%,正确答案:75%;
(6)Ksp[Cr(OH)3]=C(Cr3+)×C3(OH-),1.0×10-32 =1×10-5 mol·L-1×C3(OH-)
C(OH-)=1.0×10-9 mol·L-1,POH=9.0,PH=5.0,因此常温下要除去废液中多余的Cr3+,使铬离子沉淀完全,调节pH至少为5.0,正确答案:5.0。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.直径介于1nm~100nm之间的微粒称为悬浊液
B.制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸
C.胶体与浊液的本质区别是其稳定性,胶体属于介稳体系
D.利用丁达尔效应可以区分溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
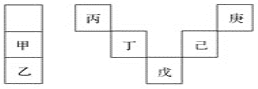
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的合成路线如下,完成下列内容
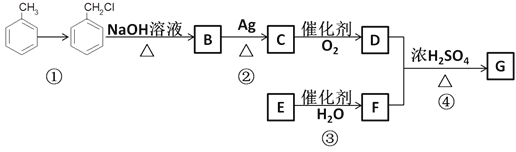
已知:①R—Cl![]() R—OH;②RCHO
R—OH;②RCHO![]() RCOOH;
RCOOH;
③E的产量可衡量一个国家石油化工的发展水平
(1)反应①反应条件为____________。
(2)B中所含官能团名称为___________。
(3)反应②的化学方程式为________________________________________________________。
简述验证是有C生成的操作及现象___________________________。
(4)反应③的反应类型为__________。
(5)反应④的化学方程式为___________________________________________________。
(6)G有很多同分异构体,则满足下列条件的同分异构体有________种。
①含有一个羧基 ②含有一个苯环 ③苯环上有三个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH![]() +3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
+3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
A. 反应中氮元素被氧化,氯元素被还原
B. 还原性:NH4+>Cl-
C. 反应中每生成1 mol N2,转移6 mol电子
D. 经此法处理过的废水可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
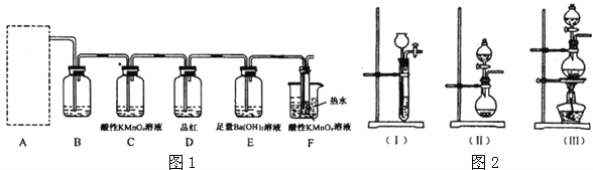
试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同一系列中,所有同系物都具有
A.相同的分子量和相同的物理性质
B.相同的物理性质和相似的化学性质
C.相似的化学性质和相同最简式
D.相同的通式,相似的化学性质,分子组成相差一个或若干个某种原子团
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com