
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
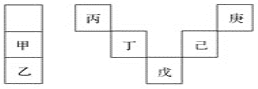
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2 ↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号);H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(2)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO4-+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4____mL,配制中需要用到的主要玻璃仪器是(填序号)______。A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是______________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
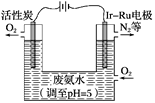
①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH4+)________(填“>”“<”或“=”)c(NO3-)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为:______________________。
③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
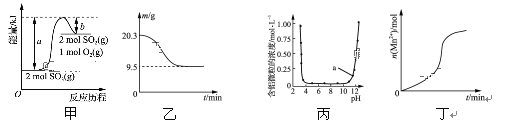
A. 由图甲可知,2SO3(g)![]() 2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1
2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1
B. 图乙表示0.1 mol MgCl2·6H2O在空气中充分加热时残留固体质量随时间的变化
C. 图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中存在大量Al3+
D. 图丁表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1的H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对反应有催化作用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:

(1)化合物C中含氧官能团的名称为________、________。
(2)D→E的反应类型为________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:____________________。
①不能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
(4)化合物B的分子式为C10H14O,写出B的结构简式:________________。
(5)已知: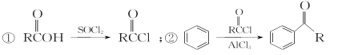 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备![]() ,写出相应的合成路线流程图________________ (无机试剂任用,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图________________ (无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确且能达到相应目的的是
选项 | 实验目的 | 实验操作 |
A | 称取2.0gNaOH固体 | 先在托盘上各放1张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
B | 配制稀硫酸 | 先将浓硫酸加入烧杯,后倒入蒸馏水 |
C | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
D | 检验溶液中是否有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 0.1 mol·L1 Na2S溶液与0.1 mol·L1 NaHS溶液等体积混合:3c(Na+)2c(HS)=2c(S2)+2c(H2S)
B. 向20 mL 0.1 mol·L1 NH4HSO4溶液中滴入0.1 mol·L1 NaOH溶液 20 mL:2c(![]() )=c(NH3·H2O)+c(
)=c(NH3·H2O)+c(![]() )
)
C. 10 mL 0.1 mol·L1 CH3COONa溶液与6 mL 0.2 mol·L1盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
D. 0.2 mol·L1 NaHCO3溶液和0.1 mol·L1 NaOH溶液等体积混合:3c(![]() )+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
)+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近发现两种粒子:第一种是由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法正确的是
A. “四中子”的粒子不显电性 B. “四中子”的电子数为4
C. 第二种粒子是氧元素的另一种同位素 D. 第二种粒子是一种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:
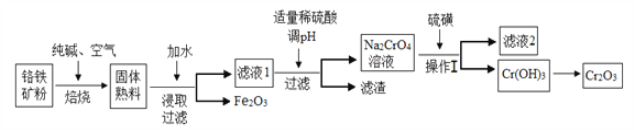
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,该步骤不能使用陶瓷容器,原因是____________________________________。
8Na2CrO4+2Fe2O3+8CO2,该步骤不能使用陶瓷容器,原因是____________________________________。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:___________________________。
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为________________________。滤渣中除Al(OH)3外还有__________(填化学式)。
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为______%。
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______,才能使铬离子沉淀完全。(已知溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Cr(OH)3的溶度积常数为1.0×10-32。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物在一定条件下,既能发生消去反应,又能发生水解反应的是( )
①CH3Cl ② ![]() ③
③ ![]() ④
④![]()
A. ①② B. ②③④ C. ② D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com