
【题目】强碱性的无色透明溶液中,能大量共存的离子组是( )
A.K+、Na+、SO42-、CO32-B.Mg2+、NH4+、NO3-、Cl-
C.Ba2+、K+、Cu2+、Cl-D.Na+、Ag+、HCO3-、Cl-
科目:高中化学 来源: 题型:
【题目】某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是下列中的( )
A.Na+B.OH-
C.S2-D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助于图像这一表现手段以清晰地突出实验装置的要点,形象地阐述化学过程的原理。 下列有关化学图像表现的内容正确的是


A. 测定一定时间内生成 H2 的反应速率 B. 提取海带中的碘
C. 检验火柴燃烧产生的 SO2 D. 证明非金属性:Cl>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 相同温度时,气体分子间的距离一定相等
B. 2gH2和2gO2能恰好反应生成4gH2O
C. 3.2gO3中含有的氧原子数为1.204×1023个
D. 1 mol·L-1 MgCl2溶液中含Cl-数为1.204×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.直径介于1nm~100nm之间的微粒称为悬浊液
B.制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸
C.胶体与浊液的本质区别是其稳定性,胶体属于介稳体系
D.利用丁达尔效应可以区分溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.60gCuSO4固体置于下图所示的装置(固定及夹持类仪器未画出)中加热到1100℃,使其分解,分解过程中可以观察到:石英管中固体由白色变为黑色,最终变为红色;BaCl2溶液中生成白色沉淀,品红溶液褪色,集气瓶中收集到无色气体。
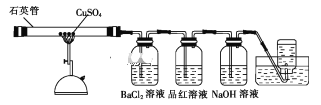
(1)石英主要成分的化学式是_____;高温分解CuSO4固体使用石英管而不使用普通玻璃管的原因是_____。
(2)石英管中剩余红色固体质量为0.72 g,经检测为不含硫元素的纯净物。则该固体的化学式为__。
(3)将BaCl2溶液中生成的白色沉淀过滤并洗涤,向洗涤后的沉淀中加入稀盐酸,无明显现象。
①沉淀的化学式为_____。
②检验沉淀是否洗净的方法是___。
(4)若NaOH溶液足量,则其中发生反应的离子方程式为____。
(5)集气瓶中收集的无色气体是____(填化学式),检验该气体的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 平衡 常数 | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2.0 | 4.0 | 3.2 | K1 |
乙 | 1 | T2 | 1.0 | 2.0 | 1.2 | K2 |
下列说法正确的是( )
A. K1=12.8
B. T1<T2
C. T1℃时向甲容器中再充入0.1 mol H2O(g),则平衡正向移动,CO2(g)的体积分数增大
D. 若在T2温度下,向2 L密闭容器中充入1.0 mol CO2和2.0 mol H2,达平衡时,CO2的转化率小于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
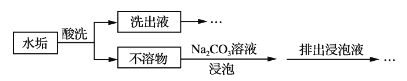
(1)“酸洗”时,一般不选用稀硫酸的原因是_______________________________。
(2)“不溶物”用碳酸钠溶液浸泡的目的是________________________________(用离子方程式表示)。
(3)为防止洗出液中的Fe3+腐蚀铁质管道,常在洗出液中加入SnCl2溶液,反应中Sn2+转化为Sn4+,则Sn2+与Fe3+反应的物质的量之比为________。
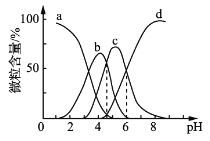
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是_____________________(用平衡移动原理解释)。HR2-电离常数为Ka3,请根据图示信息计算出pKa3=________(pKa3=-lgKa3)。
(5)利用如图2所示装置对锅炉水(含Ca2+、Mg2+、HCO3—)进行预处理,可有效防止锅炉水垢的形成。写出电解过程中,Ca2+形成沉淀的电极反应方程式:______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的合成路线如下,完成下列内容
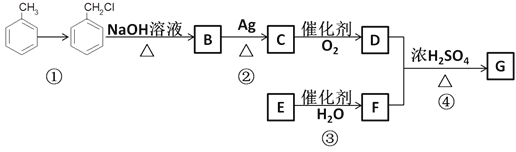
已知:①R—Cl![]() R—OH;②RCHO
R—OH;②RCHO![]() RCOOH;
RCOOH;
③E的产量可衡量一个国家石油化工的发展水平
(1)反应①反应条件为____________。
(2)B中所含官能团名称为___________。
(3)反应②的化学方程式为________________________________________________________。
简述验证是有C生成的操作及现象___________________________。
(4)反应③的反应类型为__________。
(5)反应④的化学方程式为___________________________________________________。
(6)G有很多同分异构体,则满足下列条件的同分异构体有________种。
①含有一个羧基 ②含有一个苯环 ③苯环上有三个取代基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com