
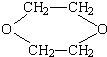 是一种常见的溶剂,是它可以通过下列路线制得:
是一种常见的溶剂,是它可以通过下列路线制得: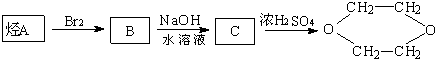
| A、乙烯 | B、乙醇 | C、乙二醇 | D、乙醚 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、全部 | B、①③④⑤⑥ |
| C、②③⑥ | D、②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
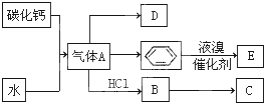 C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,它可以催熟果实.根据以下化学反应框图填空:
C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,它可以催熟果实.根据以下化学反应框图填空:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)=c(OH-)=10-6 mol?L-1溶液 |
| B、pH=7的溶液 |
| C、使石蕊试液呈红色的溶液 |
| D、由强酸与强碱等物质的量反应得到的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
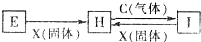 有关物质的转化关系如图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色.下列有关判断正确的是( )
有关物质的转化关系如图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色.下列有关判断正确的是( )| A、X固体可能是碘单质 |
| B、图中所示反应均为氧化还原反应 |
| C、1mol C与E溶液完全反应转移电子数为NA(NA为阿伏加德罗常数) |
| D、E、H、I溶液配制时,均需加酸防止其水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
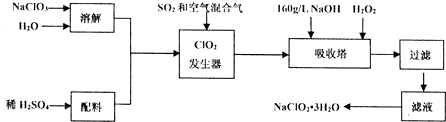
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com