
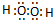 ;
;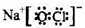 ;
;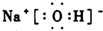 ,
,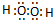 ;
;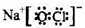 ;
;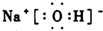 ;
;
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、将标准状况下11.2L HCl溶于水,配成250mL盐酸,溶液的物质的量浓度为2mol/L |
| B、硫酸和磷酸的摩尔质量相等 |
| C、同温同压下,相同质量的二氧化碳和二氧化硫的体积比是16:11 |
| D、2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、清晨,在树林中,常看到从枝叶间透过的一道道光柱,这是胶体产生的丁达尔效应 |
| B、某固体A能导电,一定是金属 |
| C、由同种元素组成的物质肯定属于纯净物 |
| D、由氯化铵溶液呈弱酸性可知氯化铵是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、雾属于胶体,能产生丁达尔现象 |
| B、目前的雾霾污染,无需治理借助于天气状况改善即可 |
| C、PM2.5颗粒含有重金属、多种烃等有毒物质 |
| D、汽车尾气是目前城市大气污染气体和细小颗粒物产生的一个重要来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
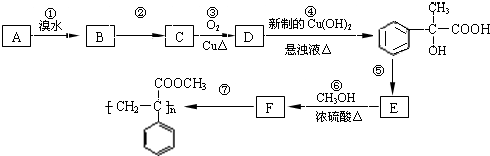
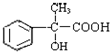 有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式:
有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式: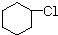 为原料合成
为原料合成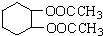
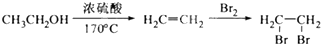 )
)查看答案和解析>>
科目:高中化学 来源: 题型:
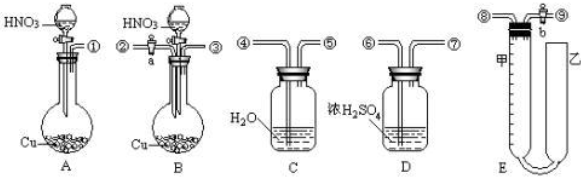
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com