
【题目】有机物A蒸气的密度是相同条件下氢气密度的29倍,5.8 g A在氧气中完全燃烧生成13.2 g CO2和5.4 g H2O。
(1)请通过计算确定A的分子式_______。(写出计算过程)
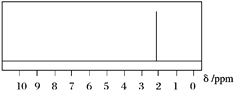
(2)已知A的1H核磁共振氢谱如下图所示,则A的结构简式为______________________。
(3)已知B、C都是A的同分异构体。
①若B可发生银镜反应,则此反应的化学方程式为__________________________________。
②若C无甲基且可与金属钠反应,则C的结构简式为______________________________。
【答案】C3H6O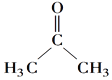 CH3CH2CHO+2Ag(NH3)2OH
CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+2Ag↓+3NH3+H2OCH2===CH—CH2OH(或
CH3CH2COONH4+2Ag↓+3NH3+H2OCH2===CH—CH2OH(或![]() —OH)
—OH)
【解析】
(1)有机化合物的蒸汽的密度是同条件下氢气的29倍,有机物的相对分子质量=29×2=58,5.8 g A的物质的量n(A)=5.8g÷58g/mol=0.1mol,燃烧生成13.2 g CO2的物质是量为n(CO2)=13.2g÷44/mol=0.3mol,5.4 g H2O的物质的量为n(H2O)=5.4g÷18g/mol=0.3mol,则有机物中碳原子个数N(C)=0.3÷0.1=3,氢原子个数N(H)=0.3×2÷0.1=6,氧原子个数N(O)=(58-3×12-6×1)÷16=1,故A的分子式为C3H6O;(2)核磁共振氢谱只有一个吸收峰,则6个H原子等效,所以是丙酮,故答案为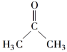 ;(3)①若B可发生银镜反应,说明分子中含有醛基,B为丙醛,反应方程式为CH3CH2CHO+2Ag(NH3)2OH
;(3)①若B可发生银镜反应,说明分子中含有醛基,B为丙醛,反应方程式为CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+2Ag↓+3NH3+H2O;②C无甲基且可与金属钠反应,则C的结构简式中含有一个羟基,其结构可能为CH2=CH—CH2OH(或
CH3CH2COONH4+2Ag↓+3NH3+H2O;②C无甲基且可与金属钠反应,则C的结构简式中含有一个羟基,其结构可能为CH2=CH—CH2OH(或![]() —OH)。
—OH)。


科目:高中化学 来源: 题型:
【题目】2017年5月4日《光明日报》报道称,中科院大连化学物理研究所的研究团队利用多功能催化剂首次实现了CO2直接加氢制汽油的过程。其转化过程如图所示。
![]()
下列说法正确的是( )
A. 反应①的产物中含有水
B. 反应②为化合反应
C. 所制得汽油的主要成分是烃和烃的含氧衍生物
D. 这种人造汽油用作汽车的燃料时,汽车尾气不含氮氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲中①②③④表示不同化学元素所组成的化合物,图乙表示由四个单体构成的化合物。以下说法不正确的是( )
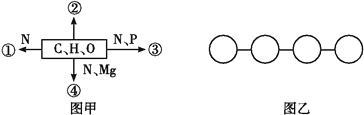
A. 若图甲中的②大量存在于皮下和内脏器官周围等部位,则②是脂肪
B. 若图甲中④能吸收、传递和转换光能,则④可用无水乙醇提取
C. 图乙中若单体是氨基酸,则该化合物彻底水解后的产物中氧原子数增加3个
D. 图乙中若单体是四种脱氧核苷酸,则该化合物彻底水解后的产物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料茉莉酮是一种人工合成的有机化合物,其结构简式为![]() ,下列关于茉莉酮的说法正确的是( )
,下列关于茉莉酮的说法正确的是( )
A. 该有机物的化学式是C10H14O
B. 1 mol该有机物与H2充分反应,消耗4 mol H2
C. 该有机物属于不饱和酮类物质,能发生银镜反应
D. 该有机物能发生加成反应,但不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学-物质结构与性质)氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态15N原子的p能级上存在_____个自旋方向相同的电子;CN—中σ键与π键数目之比为_____。
(2)碱性肥料氰氨化钙(CaCN2)的组成元素中第一电离能最小的是_______(填名称)。
(3)化合物(CH3)3N能溶于水,其原因是____________________________________,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为_______________。
(4)阳离子[(CH3)3NH]+和阴离子A按个数比4:1组成化合物,阴离子A的结构如下图所示,则s原子的杂化轨道类型是__________,阴离子A的化学式为_______________。
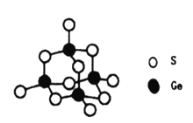
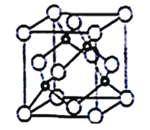
(5)立方氮化硼晶胞如下图所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为___;若晶胞边长为acm,则立方氮化硼的密度是______g·cm-3(只要求列算式,阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,某些建筑材料会产生放射性同位素氡22286Rn,从而对人体产生危害。该同位素原子的中子数和核外电子数之差为
A. 136 B. 50 C. 86 D. 222
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
A.①④ B.①②④ C.①②④⑤ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外最外层共有24个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同
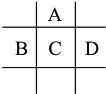
回答下列问题:
(1) A与E形成的化合物的化学式是__________.B的最高价氧化物化学式为_____________,
(2)D的单质与水反应的方程式为__________________________________________________.
(3) 向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是___________________:有关反应的离子方程式为:_____________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com