
【题目】升高温度,气体摩尔体积( )
A.随气体分子数目变化
B.随气体分子间距变化
C.一定增大
D.一定减小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应:A(s)+2B(g) ![]() C(g)+2D(g) △H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是:
C(g)+2D(g) △H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是:
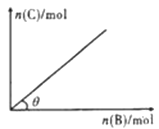
A. 增加A的物质的量,正反应速率加快
B. 平衡时,其他条件不变,当温度升高时,转化率变大
C. 图中曲线的斜率表示反应的化学平衡常数
D. 平衡时,其他条件不变,再通人B,则反应混合物的温度升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A. 每断裂1molA-A键,同时也断裂1molB-B键
B. 浓度之比c(A2): c(B2): c(AB)=1:1:2
C. 各物质的浓度不再改变
D. 当混合物的密度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,体积为2L的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
① 3min内用N2表示的化学反应速率为____________。②H2的转化率是____________。
(2)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
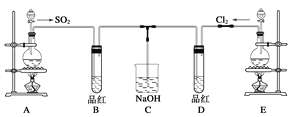
a.实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为____________;
MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为____________;
b.①反应开始一段时间后,观察到D试管中的品红溶液出现的现象是:
D:_____________________________________________________________。
②停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:____________________________________,D:________________________________。
c.另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、T四种短周期元素。X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)常见的两种化合物。
X | |
Y | Z |
(1)各元素的符号是X______,Y________,Z________、T___________。
(2)Y原子的结构示意图为______________________________________________。
(3)用电子式表示Y与T组成的化合物的形成过程:_____________________。
(4)X和Y的氢化物的稳定性_________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为周期表的一小部分,A、B、C、D的位置关系如图所示。且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:

(1)在B、C、D最高价氧化物对应水化物中,B的化学式为______,其中酸性最强的是_____。
(2)在A、B、C、所形成氢化物中,A的化学式:___________,其中最稳定的是___________。
(3)写D的单质与C的氢化物反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于漂白粉的叙述正确的是( )
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空气中久置后会变质
C.漂白粉是由Cl2与烧碱制得的
D.在使用漂白粉时应用浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,100 ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取( )
A.加入少量CH3COONa固体 B.通入少量氯化氢气体
C.升高温度 D.加入少量氢氧化钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物种类较多,用途广泛。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,其制备的反应原理为:Na2SO3+ SO2==Na2S2O5
某研究小组利用下图装置制取Na2S2O5,盛硫酸的仪器叫分液漏斗。

(1)写出装置甲中发生反应的化学方程式__________________。
(2)关闭K3,要求只检查装置甲的气密性,请至少写出两种不同的操作方法。
方法1:_________________________。
方法2:_________________________。
方法3:_________________________。
(3)装置乙的作用是________________。
(4)写出焦亚硫酸钠晶体在空气中被完全氧化的化学方程式_____________。
II:硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3 、FeCl2、CuCl2的混合溶液中反应用以回收S,其物质转化如图所示。

(1)反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为 _____________。
(2)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施是___________________。
(3)写出图中各步转化的化学方程式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com