
【题目】(1)在一定条件下,体积为2L的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
① 3min内用N2表示的化学反应速率为____________。②H2的转化率是____________。
(2)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
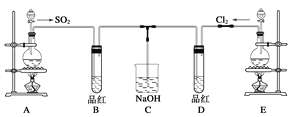
a.实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为____________;
MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为____________;
b.①反应开始一段时间后,观察到D试管中的品红溶液出现的现象是:
D:_____________________________________________________________。
②停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:____________________________________,D:________________________________。
c.另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_______________________________。
【答案】 v(N2) =0.2 mol·L-1·min-1 60% 3mol 品红溶液褪色 褪色的品红溶液又恢复成红色 无明显现象 Cl2+SO2+2H2O=2HCl+H2SO4
【解析】(1)因为生成NH3(g)2.4mol,根据反应N2(g)+3H2(g)![]() 2NH3(g)得,反应的N2(g)为1.2mol,反应的H2(g)为3.6mol,所以①3min内用N2表示的化学反应速率为:1.2mol÷2L÷3min=0.2molL-1min-1;②H2的转化率是:3.6mol÷6.0mol×100%=60%。
2NH3(g)得,反应的N2(g)为1.2mol,反应的H2(g)为3.6mol,所以①3min内用N2表示的化学反应速率为:1.2mol÷2L÷3min=0.2molL-1min-1;②H2的转化率是:3.6mol÷6.0mol×100%=60%。
(2)a.在反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,每有4mol HCl参与反应,被氧化的氯化氢是2mol,即被氧化的氯化氢占参与反应的50%,6 molHCl参加反应被氧化的氯化氢是3mol,转移的物质的量为3mol。
MnCl2+Cl2↑+2H2O中,每有4mol HCl参与反应,被氧化的氯化氢是2mol,即被氧化的氯化氢占参与反应的50%,6 molHCl参加反应被氧化的氯化氢是3mol,转移的物质的量为3mol。
b.SO2具有漂白性,二氧化硫通入品红溶液中,品红褪色;SO2的漂白具有可逆性,褪色后的溶液加热时又恢复原来的红色.氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色,次氯酸的漂白不可逆,加热时,不能恢复红色。
故答案为:①品红溶液褪色;②B:褪色的品红又恢复成红色;D:无明显现象。
c.氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,生成物都没有漂白性,所以SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不退色。故答案为:Cl2+SO2+2H2O=2HCl+H2SO4。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D都是短周期元素,原子半径D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。请回答下列问题:
(1)A元素在周期表中的位置:__________;B、D两元素形成的化合物的电子式:______。
(2)元素B、C、D的简单离子半径的大小顺序:________(用离子符号回答)。
(3)C、D两元素最高价氧化物对应水化物的碱性强弱关系:_____>______(用化学式表示)。
(4)B、C形成的化合物与D的最高价氧化物对应水化物反应的化学方程式:_______。
(5)C的单质在D的最高价氧化物对应水化物的溶液中反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H10O2的芳香族化合物并且能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)( )
A.6种
B.8种
C.12种
D.14种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Al(OH)3的性质,某同学取两支洁净的试管,加入适量Al(OH)3悬浊液,然后分别滴加足量的:①稀盐酸;②NaOH溶液。下列有关实验现象的描述正确的是:
A. ①、②都澄清B. ①、②都浑浊C. ①澄清,②浑浊D. ①浑浊,②澄清
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界里常见金属元素存在最多的是Al,其次是铁,接着是铜。然而人类冶炼金属获得成功最早的反而是含量少的铜,含量最多的铝最迟冶炼出来,究其原因,合理的是( )
A.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发
B.铜矿颜色较深,易发现,铝矿颜色较浅,不易发现
C.铜矿较易还原,铝矿很难还原
D.以上说法是错误的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类是工业上重要的有机原料,具有广泛用途。下图是乙酸乙酯的合成路线图,已知A能与银氨溶液反应析出银镜,B的水溶液可以溶解CaCO3,E可作果实催熟剂。

请完成下列问题:
(1)A的名称是_________;B中所含的官能团是____________;反应③的类型是_____________;反应④的类型是_____________。
(2)A的结构简式为___________________;E的结构简式为_________________________。
(3)请写出反应①、③、④的化学方程式:
①__________________________________________________________。
③__________________________________________________________。
④__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.氯化钠溶液能导电,所以氯化钠溶液是电解质
B.氯化钠固体不导电,所以氯化钠不是电解质
C.氯化氢溶液能导电,所以氯化氢是电解质
D.氯气溶于水能导电,所以氯气是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com