
【题目】酯类是工业上重要的有机原料,具有广泛用途。下图是乙酸乙酯的合成路线图,已知A能与银氨溶液反应析出银镜,B的水溶液可以溶解CaCO3,E可作果实催熟剂。

请完成下列问题:
(1)A的名称是_________;B中所含的官能团是____________;反应③的类型是_____________;反应④的类型是_____________。
(2)A的结构简式为___________________;E的结构简式为_________________________。
(3)请写出反应①、③、④的化学方程式:
①__________________________________________________________。
③__________________________________________________________。
④__________________________________________________________。
【答案】 乙醛 羧基(或—COOH) 酯化(或取代反应) 加成反应 CH3CHO CH2=CH2 2CH3CH2OH + O2![]() 2CH3CHO+2H2O CH3CH2OH + CH3COOH
2CH3CHO+2H2O CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 +H2O CH2=CH2 + HCl
CH3COOCH2CH3 +H2O CH2=CH2 + HCl![]() CH3CH2Cl
CH3CH2Cl
【解析】试题分析:乙醇能被氧气氧化为乙醛,A能与银氨溶液反应析出银镜,所以A是乙醛;乙醛能氧化为乙酸, B的水溶液可以溶解CaCO3,所以B是乙酸,E可作果实催熟剂,E是乙烯;氯乙烷在氢氧化钠水溶液中加热生成乙醇,C是乙醇,乙酸、乙醇发生酯化反应生成乙酸乙酯。
解析:根据以上分析,(1)A的名称是乙醛;B是乙酸,含的官能团是羧基;乙酸、乙醇发生反应生成乙酸乙酯和水,类型是酯化(或取代反应);乙烯与氯化氢反应生成氯乙烷,反应类型是加成反应。
(2)乙醛的结构简式为CH3CHO;乙烯的结构简式为CH2=CH2。
(3)请写出反应①、③、④的化学方程式:
①乙醇氧化为乙醛的方程式为2CH3CH2OH + O2![]() 2CH3CHO+2H2O 。
2CH3CHO+2H2O 。
③乙酸、乙醇发生反应生成乙酸乙酯和水的方程式为CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 +H2O 。
CH3COOCH2CH3 +H2O 。
④乙烯与氯化氢反应生成氯乙烷的方程式为CH2=CH2 + HCl![]() CH3CH2Cl。
CH3CH2Cl。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】加成反应也是有机化学中的一类重要的反应类型,下列物质各组物质中不能全部发生加成反应的是 ( )
A. 乙烷、乙烯 B. 乙烯、乙炔 C. 氯乙烯、溴乙烯 D. 苯、2-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,体积为2L的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
① 3min内用N2表示的化学反应速率为____________。②H2的转化率是____________。
(2)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
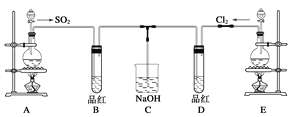
a.实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为____________;
MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为____________;
b.①反应开始一段时间后,观察到D试管中的品红溶液出现的现象是:
D:_____________________________________________________________。
②停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:____________________________________,D:________________________________。
c.另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为周期表的一小部分,A、B、C、D的位置关系如图所示。且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:

(1)在B、C、D最高价氧化物对应水化物中,B的化学式为______,其中酸性最强的是_____。
(2)在A、B、C、所形成氢化物中,A的化学式:___________,其中最稳定的是___________。
(3)写D的单质与C的氢化物反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于漂白粉的叙述正确的是( )
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空气中久置后会变质
C.漂白粉是由Cl2与烧碱制得的
D.在使用漂白粉时应用浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与链烃相比,苯的化学性质的主要特征为 ( )
A. 难氧化、难取代、难加成 B. 易氧化、易取代、易加成
C. 难氧化、易取代、难加成 D. 易氧化、易取代、难加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,100 ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取( )
A.加入少量CH3COONa固体 B.通入少量氯化氢气体
C.升高温度 D.加入少量氢氧化钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g) + O2(g) ![]() 2SO3(g) + Q
2SO3(g) + Q ![]()
(1)若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
|
| 平衡常数K |
________ | ________ | ________ |
(2)2SO2(g) + O2(g) ![]() 2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
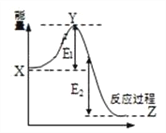
A.加入催化剂,X点位置升高
B.反应热 = E1 + E2
C.反应物总能量低于生成物
D.加入催化剂,E2不变
(3)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
实验1从开始到反应达到化学平衡时,用去时间2分钟,则υ(SO2)表示的反应速率为_________;T1________T2(填“>”、“<”或“=”)。制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
(4)0.1mol/L的NaHSO3溶液中c(H+) > c(OH-),用水解和电离理论的角度解释其原因___________________;若往溶液中加入氨水至中性,则c(Na+)______c(HSO3-) + c(SO32-) + c(H2SO3)(填“>”、“﹤”或“=”)。
(5)往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-)的比值____________(填“变大”、“变小”或“保持不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com