
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯璜化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的化学方程式为SO2(g)+Cl2(g) ![]() SO2Cl2(l)△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l)△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:
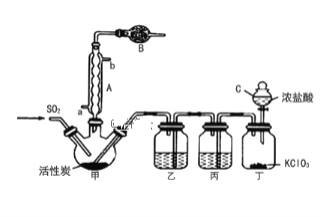
(1)仪器B的名称是______,作用是________。
(2)若无装置乙硫酰氯会发生水解,则硫酰氯水解反应的化学方程式为_______。
(3)写出丁装置中发生反应的化学反应方程式____________。
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有____(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快③若三颈烧瓶发烫,可适当降温④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为______。此方法得到的产品中会混有硫酸,从分解产物中分离出硫酰氯的方法是_____。
(6)工业上处理SO2废气的方法很多,例如可以用Fe2(SO4)3酸性溶液处理,其工艺流程如下,溶液②转化为溶液③发生反应的离子方程式为_________。
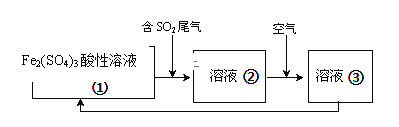
【答案】干燥管 吸收未反应完的氯气和二氧化硫,防止污染空气;防止空气中水蒸气进人甲,防止SO2Cl2水解 SO2Cl2+2H2O═H2SO4+2HCl KClO3+6HCl=KCl+3Cl2+3H2O ①②③ 2ClSO3H=H2SO4+SO2Cl2 蒸馏 4H++4Fe2++O2=4Fe3++2H2O
【解析】
(1)根据装置图判断仪器B的名称,根据SO2Cl2易水解回答;
(2)SO2Cl2水解为盐酸和硫酸;
(3)丁装置中氯酸钾与浓盐酸反应制备氯气;
(4)根据影响反应速率的因素、平衡移动原理分析;
(5)根据元素守恒,氯磺酸(ClSO3H)分解生成SO2Cl2和硫酸;
(6)溶液②中的Fe2+被氧气氧化为Fe3+;
(1)根据装置图,仪器B的名称是干燥管;氯气和二氧化硫有毒,能被碱性物质吸收,SO2Cl2易水解,所以装置B的作用是吸收未反应完的氯气和二氧化硫,防止污染空气;防止空气中水蒸气进人甲,防止SO2Cl2水解;
(2)SO2Cl2水解为盐酸和硫酸,水解方程式是SO2Cl2+2H2O═H2SO4+2HCl;
(3)丁装置中氯酸钾与浓盐酸反应制备氯气;发生反应的化学反应方程式是KClO3+6HCl=KCl+3Cl2+3H2O;
(4)①正反应放热,降低温度有利于平衡正向移动,先通冷凝水,再通气,能提高SO2Cl2的产率,故选①;
②控制气流速率,宜慢不宜快,能使反应充分,有利于提高SO2Cl2的产率,故选②;
③正反应放热,适当降温,使平衡正向移动,能提高SO2Cl2的产率,故选③;
④正反应放热,加热三颈烧瓶,平衡逆向移动, SO2Cl2的产率降低,故不选④;
(5)氯磺酸(ClSO3H)分解生成SO2Cl2和硫酸,反应方程式是2ClSO3H=H2SO4+SO2Cl2;硫酰氯与硫酸的沸点不同,可用蒸馏法分离出硫酰氯;
(6)溶液②中的Fe2+被氧气氧化为Fe3+,反应的离子方程式是4H++4Fe2++O2=4Fe3++2H2O;


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种重要香料,用途广泛,它的一种合成路线如下:
![]()
已知如下信息:
①A有两个处于邻位的取代基,A、B、C、D均能使FeCl3溶液发生显色反应。
②
③D、E能使溴水褪色,E中含有两个六元环。
回答相关问题:
(1)A的名称是___________;A→B的反应类型是_________________。
(2)C中的官能团有____________、__________(写名称)。
(3)C→D发生反应的化学方程式为_____________________________。
(4)B的结构简式为___________,E的结构简式为______________。
(5)D的同分异构体中,符合下列条件的结构共有________种。其中核磁共振氢谱有4组峰,且面积比为3:2:2:1的是________________(写结构简式)。
①苯环上只有两个取代基(不含![]() 结构),②能发生水解反应且遇FeCl3溶液不显色,③除苯环外,不含其它环状结构,④水解产物之一能与FeCl3溶液发生显色反应。
结构),②能发生水解反应且遇FeCl3溶液不显色,③除苯环外,不含其它环状结构,④水解产物之一能与FeCl3溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)填写下列表格:
物质 | 分子数 | 质量/g | 物质的量/ mol | 摩尔质量/(g |
O2 | __ | 8.0 | __ | __ |
H2SO4 | 3.01×1023 | __ | __ | __ |
H2O | __ | __ | 0.5 | __ |
(2)147gH2SO4的物质的量是____;0.5molH2SO4的质量是____g,其中含有____mol H;2 mol H2SO4中含有H2SO4分子数为_____个,含氢原子数为____个。
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为____,R的相对原子质量为____。含R的质量为1.6 g的Na2R,其物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为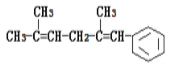 ,判断下列说法中不正确的是( )
,判断下列说法中不正确的是( )
A.它可以使酸性KMnO4溶液褪色
B.它可发生取代反应、加成反应、加聚反应、氧化反应
C.1mol该有机物燃烧消耗氧气为18.5mol
D.它与氢气发生加成反应,最多可以消耗4mol氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
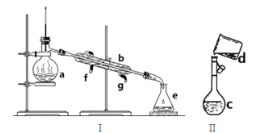
(1)写出下列仪器的名称:a._____ b.______ c.___
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是______,将仪器补充完整后进行实验的名称为___;冷凝水由___(填f或g)口通入,____口流出。现需配制250mL0.2mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)键线式![]() 的系统命名为 __________________;
的系统命名为 __________________;
(2)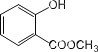 中含有的官能团为_______________;
中含有的官能团为_______________;
(3)2-甲基-1-丁烯的结构简式____________________;
(4)相对分子质量为 72 且一氯代物只有一种的烷烃的结构简式________________;
(5)分子式为 C2H6O 的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是________________;
A.红外光谱 B.核磁共振氢谱 C.质谱法 D.与钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
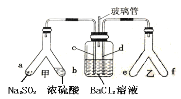
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2OH d.CH3CH2Br
(4)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
![]()
反应②的化学方程式为_________。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_____________,反应类型是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com