
【题目】为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
A. NaOH B. Na2CO3 C. NH3·H2O D. MgCO3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
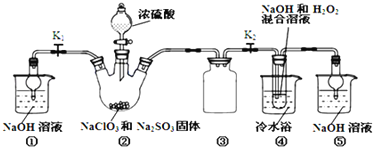
完成下列填空:
(1)装置②中产生ClO2的化学方程式为______.装置③的作用是______.
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②______;③______;④低于60℃干燥,得到成品.(选择合适的操作编号填空)
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤
D.冰水洗涤 E.38~60℃的温水洗涤
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是______;
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32﹣═2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为________________________________.重复滴定2~3次,测得所用Na2S2O3溶液体积的平均值为20.00mL.该样品中NaClO2的质量分数为______.
(5)Na2FeO4和ClO2在水处理过程中分别被还原为Fe3+和Cl﹣.如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > .______(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L的HR溶液中逐渐滴入0.1mol/L的NH3·H2O溶液, 所得溶液pH及导电性变化如图。下列分析不正确的是

A.a~b点导电能力增强,说明HR为弱酸
B.b点溶液pH=7,说明NH4R没有水解
C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)×c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是
A. 碱性氧化物:Na2O、CaO、MgO、
B. 碱:纯碱、烧碱、熟石灰、苛性钠
C. 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D. 氧化物:CO2、NO、SO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
提示:BaSO4(s) ![]() Ba2+(aq)+SO
Ba2+(aq)+SO![]() (aq)的平衡常数Ksp=c(Ba2+)·c(SO
(aq)的平衡常数Ksp=c(Ba2+)·c(SO![]() ),称为溶度积常数。
),称为溶度积常数。
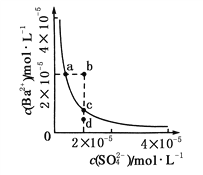
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。他们设计如下实验装置(如图),请你参与探究,并回答问题:
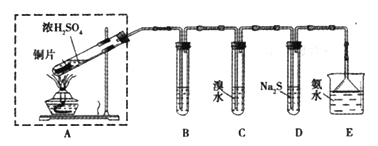
(1)装置E中的氨水可吸收少量多余的SO2,发生反应的离子方程式是____________,E装置中使用倒立的漏斗的目的是________________。
(2)装置B用于检验SO2的漂白性,其中所盛试剂为____________________,装置D用于检验SO2的______________性质;
(3)装置C中发生反应的离子方程式为_______________;
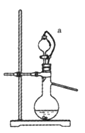
(4)如果用硫酸和亚硫酸钠反应制取二氧化硫,装置如图所示。其中a导管的作用是_______,写出烧瓶中反应的化学方程式 ___________________。
(5)他们拟用以下方法(如图)测定空气中SO2含量(假设空气中无其他还原性气体)。
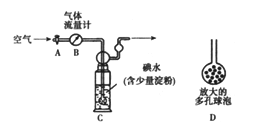
方案1:
① 洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量______(填“偏高”、“偏低”或“无影响”)。
方案Ⅱ:
![]()
② 实验中若通过的空气的体积为33.6L(已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该空气中二氧化硫的体积百分含量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫酸的性质,叙述正确的是( )
A.浓硫酸因具有吸水性,所以能使蔗糖炭化
B.实验室用浓硫酸与亚硫酸钠反应制SO2 , 体现浓硫酸的强氧化性
C.常温下,铁遇浓硫酸发生钝化,铁表面生成致密的氧化膜
D.浓硫酸作干燥剂,可以干燥H2、CO2、NH3、Cl2等气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com