
����Ŀ��ijʵ��С��ͬѧ��̽��SO2�����ʣ����ⶨ������SO2�ĺ����������������ʵ��װ�ã���ͼ�����������̽�������ش����⣺
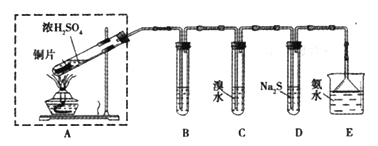
��1��װ��E�еİ�ˮ���������������SO2��������Ӧ�����ӷ���ʽ��____________��Eװ����ʹ�õ�����©����Ŀ����________________��
��2��װ��B���ڼ���SO2��Ư���ԣ�������ʢ�Լ�Ϊ____________________��װ��D���ڼ���SO2��______________���ʣ�
��3��װ��C�з�����Ӧ�����ӷ���ʽΪ_______________��
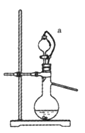
��4�������������������Ʒ�Ӧ��ȡ��������װ����ͼ��ʾ������a���ܵ�������_______��д����ƿ�з�Ӧ�Ļ�ѧ����ʽ ___________________��
��5�������������·�������ͼ���ⶨ������SO2�����������������������ԭ�����壩��
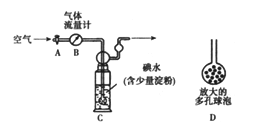
����1:
�� ϴ��ƿC����Һ��ɫ��ʧ����û�м�ʱ�رջ���A�����õ�SO2����______���ƫ�ߡ�����ƫ�͡�����Ӱ�족����
������:
![]()
�� ʵ������ͨ���Ŀ��������Ϊ33.6L���ѻ���ɱ�״�������������ù�������Ϊ0.233g����ͨ������ȷ���ÿ����ж������������ٷֺ���____________��
���𰸡� SO2+2NH3��H2O=2NH4++SO32-+H2O ������ Ʒ����Һ ������ 2H2O+SO2+Br2=4H++SO42-+2Br- ʹ©���е�Һ����˳������ Na2SO3+H2SO4=Na2SO4+ SO2+H2O ƫ�� 0.067%
����������1�����������ж�����ֱ���ſգ��Ҷ���������������������ܺͼ���Һ��Ӧ���������κ�ˮ�������ð�ˮ���ն����������ӷ���ʽΪ��SO2+2NH3��H2O=2NH4++SO32-+H2O�����ڶ����������弫�����ڰ�ˮ������װ����ѹǿ���罵�ͣ�������ѹѹ��Һ����룬�������������õ��۵�©������Բ�β�������ϴ��л������ã��ܷ�ֹ��������2��װ��B���ڼ���SO2��Ư���ԣ�SO2����ijЩ��ɫ������Ʒ�����γ���ɫ�����ʣ����SO2��Ư���ԣ���װ��B��Ʒ����Һ���飬��װ��D�з�����Ӧ��SO2+2H2S=3S��+H2O����Ӧ��SO2�������������������ԣ�H2S�ǻ�ԭ�������ֻ�ԭ�ԣ���3����װ��C��SO2����ˮ������Ӧ��2H2O+SO2+Br2=4H++SO42-+2Br-�� ��4��a�������ӷ�Һ©����������ƿ����������ƽ���Һ©����������ƿ���ѹǿ��ʹҺ��˳�����£����з�Ӧ�ķ���ʽΪNa2SO3+H2SO4=Na2SO4+ SO2��+H2O����5����ϴ��ƿC����Һ��ɫ��ʧ��û�м�ʱ�رջ���A����ͨ��β��������������SO2����ƫ�ͣ���0.233g���ᱵ�����ʵ���Ϊ0.233g��233g/mol=0.001mol��������Ԫ���غ㣬��֪n��SO2��=n��H2SO4��=n��BaSO4��=0.01mol���ʶ�����������Ϊ0.01mol��22.4L/mol=0.0224L������������������Ϊ0.0224L/33.6L��100%��0.067%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ӵ���Һ�зֱ����NaOH����(��Һ�������)������������Ũ�ȼ�С����
A. Cl- B. OH- C. AlO2- D. HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥMgCl2������Һ�е�Fe3�������ڼ��Ƚ���������¼���һ���Լ������˺�������Һ�м������������ᣬ�����Լ��ǣ� ��
A. NaOH B. Na2CO3 C. NH3��H2O D. MgCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ����������ȷ����
A. ������ȼ����Ϊ285.5 kJ��mol��1����ˮ�ֽ���Ȼ�ѧ����ʽΪ2H2O(l)===2H2(g)��O2(g) ��H����285.5 kJ��mol��1
B. ��֪2C(ʯī��s)��O2(g)===2CO(g) ��H����221 kJ��mol��1����ʯī��ȼ����Ϊ110.5 kJ��mol��1
C. ��֪N2(g)��3H2(g) ![]() 2NH3(g) ��H����92.4 kJ��mol��1������һ�������½�1 mol N2 ��3 mol H2����һ�ܱ������г�ַ�Ӧ�����ɷų�92.4 kJ������
2NH3(g) ��H����92.4 kJ��mol��1������һ�������½�1 mol N2 ��3 mol H2����һ�ܱ������г�ַ�Ӧ�����ɷų�92.4 kJ������
D. ��֪�Ҵ�����ϩ��ȼ���ȷֱ�Ϊ1 366.8 kJ��mol��1��1 411.0 kJ��mol��1������ϩˮ�����Ҵ����Ȼ�ѧ����ʽΪC2H4(g)��H2O(l)===C2H5OH(l) ��H����44.2 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����������������ȷ����
A. ����������һ���Ǽ���������ǽ���������һ��������������
B. ���������ﶼ����ˮ����������
C. ���������ﶼ����ˮ�������ɼ�
D. ����������һ���ǽ�����������������ﲻһ���Ƿǽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ��ˮ������Ե��ǣ� ��
A.FeCl3
B.Na2CO3
C.CH3COOH
D.KHSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H��N��O��Na��S��Cl������ѧ��ѧ�еij���Ԫ�أ���������ش�����ЩԪ���йص����⣺
(1)����Naԭ�ӽṹʾ��ͼ_______��Na2O2�������������������ʽΪ_______��
(2)Cl2��һ�ִ�����Ⱦ�װ��Һ�ȵĸ�ƿ��Ӧ���ı�ǩ��_______�����ţ���

����й©����NaHSO3��Һ��������д����ص����ӷ�Ӧ����ʽ_____________��
(3)25Cʱ������pH��ֽ���0.1mol/L��ˮ��pHԼΪ11������Թ������ˮ�ĵ��볣��ԼΪ_____����10mL����Һ��ͨ�����������������ܽ��������Һ�¶Ⱥ������С�仯����Һ��![]() ��_______(����� ����С������ȷ��������
��_______(����� ����С������ȷ��������
(4)�����ֻ�����ͬʱ����������Ԫ���е�����Ԫ�ء��������ֻ��������Һ��Ϻ�ǡ����ȫ��Ӧ��������֮һM�Ժ���������Ԫ�أ��÷�Ӧ�����ӷ���ʽΪ______________����M��Һ��pH =5������ˮ�������c(H+)=_______mol/L������Һ����Ũ���ɴ�С��˳��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(H2NNH2)��һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯����ͼ��ʾ����֪����1 mol��ѧ�����������(kJ)��N��NΪ942��O=OΪ500��N��NΪ154�������1 mol N��H�����������(kJ)�ǣ�
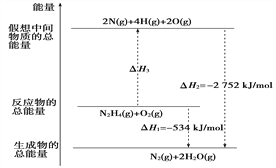
A. 194 B. 391 C. 516 D. 658
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������з���Ҫ��������ĸ������Ӧλ��
A��O2��O3 B.![]() C��
C��![]() C C��CH3CH2CH2CH3��
C C��CH3CH2CH2CH3��![]()
D�� E��CH3CH2CH2CH3��
E��CH3CH2CH2CH3��![]()
��___________����������Ϊͬλ�ء���__________���������ʻ�Ϊͬ�������塣
��___________��������������ͬϵ���___________�������ʻ�Ϊͬ���칹�塣
��___________����������ͬһ���ʡ�
��2��һ���¶��£���3 molA�����1mol B����ͨ��һ�ݻ��̶�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)��B(g)![]() xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ__________________��XΪ________������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ��________ 0.8mol/L������ڣ�С�ڻ���ڡ�����
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ__________________��XΪ________������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ��________ 0.8mol/L������ڣ�С�ڻ���ڡ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com