
关于如图所示装置的叙述正确的是( )

A.甲乙装置中的铜片都作正极
B.甲乙装置中的溶液内的H+均在锌片上被氧化
C.甲乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片上有气泡生成,乙装置中的铜片质量减小
科目:高中化学 来源:2015届辽宁省分校高三上学期期初考试化学试卷(解析版) 题型:选择题
金属加工后的废切削液中含2-5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:第一步:NaNO2+NH4Cl=NaCl+NH4NO2 第二步:NH4NO2 N2↑+2H2O 下列对第二步反应的叙述中正确的是 ? ?
N2↑+2H2O 下列对第二步反应的叙述中正确的是 ? ?
① NH4NO2是氧化剂 ② NH4NO2是还原剂 ③ NH4NO2发生了分解反应 ④ 只有氮元素的
化合价发生了变化 ⑤ NH4NO2既是氧化剂又是还原剂
A.①③ B.①④ C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
向某烧碱溶液中通入5.28gCO2后,将溶液在低温下蒸干,得到固体物质的质量为17.32g,则该固体物质是
A .Na2CO3 B.NaHCO3 C.Na2CO3和NaOH D.Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:填空题
(6分)下图是某化学兴趣小组同学模拟石蜡油(液态烷烃混合物)深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程:

请回答下列问题:
(1)A的结构简式为_________________;(2)B中所含官能团的名称是___________________;
(3)写出下列反应的化学方程式:
①B+丙烯酸 丙烯酸乙酯___________ ②苯
丙烯酸乙酯___________ ②苯 硝基苯____________________
硝基苯____________________
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2 + SeO2+2H2O。下列叙述正确的是( )
+ SeO2+2H2O。下列叙述正确的是( )
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4 NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
当光束通过下列分散系,能观察到丁达尔现象的是( )
① 有尘埃的空气 ②稀盐酸 ③蒸馏水 ④墨水
A.②③ B.①④ C.③④ D.① ②③④
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(10分)为了证明醋酸是弱电解质,甲、乙、丙、丁、戊分别选用下列试剂进行实验: 0.1mol/L醋酸溶液、0.1mol/L盐酸、C(H+)=10-3mol/L的盐酸、C(H+)=10-3mol/L的醋酸、CH3COONa晶体、石蕊试液、pH试纸、锌粒、蒸馏水。已知:pH=-lgc(H+)
(1)甲用pH试纸测出0.10mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法 (填“正确”或“不正确”)。
(2)乙分别取用10ml 0.1mol/L盐酸和醋酸,然后加入完全一样的等量锌粒(少量),产生氢气用气球收集,通过观察实验现象为 ,则认定醋酸是弱电解质。
(3)丙取出10ml0.10mol/L醋酸溶液,滴入石蕊试液,显红色,再加入醋酸钠晶体,颜色变浅红色,也能证明醋酸是弱电解质,试从电离平衡原理解释 。
(4)丁分别取用10ml C(H+)=10-3mol/L盐酸和醋酸,然后加入完全一样的等量锌粒(足量),产生氢气用气球收集,通过比较产生气球的大小,如果醋酸产生气球 (填“大”或“小”),则认定醋酸是弱电解质。
(5)戊取用C(H+)=10-3mol/L的醋酸稀释到原来的100倍,稀释后醋酸的C(H+) 10-5mol/L
(填“>”、“<”、“=”),则认定醋酸是弱电解质。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 ( )
2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 ( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50mol/L
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)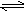 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
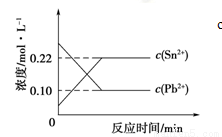
下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后, c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com