
食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水分、空气中的氧气以及光照、受热而引起的,已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O KI+I2  KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。① 加KSCN溶液显红色,该试液中含有的物质是________(用离子符号表示);CCl4中显示紫红色的物质是________(用电子式表示)。
② 第二份试液中加入足量KI固体后,反应的离子方程式为_______________________。
(2)将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?(填“是”或“否”),并说明理由:________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是________。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
(1)① Fe3+  ②5I-+IO3—+6H+=3I2+3H2O、2Fe3++2I―
②5I-+IO3—+6H+=3I2+3H2O、2Fe3++2I― 2Fe2++I2。
2Fe2++I2。
(2)否,低温制备的KI3受热易分解为I2,而I2受热易升华。
(3)AC
解析试题分析:⑴某加碘盐可能含有KIO3、KI、Mg2+、Fe3+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份。从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应: Fe3++ 3SCN-= Fe(SCN)3,Fe(SCN)呈血红色;从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成。这是因为 由于“氧化性: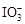 >Fe3+>I2”, 加足量KI后,
>Fe3+>I2”, 加足量KI后,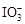 和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。由此可知该加碘盐中不含KI。所以,①该加碘盐溶液中加KSCN溶液显红色的物质是Fe(SCN)3; CCl4中显紫红色的物质是I2,电子式
和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。由此可知该加碘盐中不含KI。所以,①该加碘盐溶液中加KSCN溶液显红色的物质是Fe(SCN)3; CCl4中显紫红色的物质是I2,电子式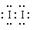 ②第二份试液中加入足量KI固体后,反应的离子方程式为:
②第二份试液中加入足量KI固体后,反应的离子方程式为: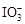 +5I-+6H+
+5I-+6H+ 3I2+3H2O ; 2Fe3++2I―
3I2+3H2O ; 2Fe3++2I― 2Fe2++I2。
2Fe2++I2。
⑵根据题目告知,KI3·H2O是在低温条件下,由I2溶于KI溶液可制得。再由题给的信息:“KI+I2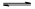 KI3”,可以推出:KI3在常温下不稳定性,受热(或潮湿)条件下易分解为KI和I2 ,KI又易被空气中的氧气氧化,I2易升华,所以KI3·H2O作为食盐加碘剂是不合适的。
KI3”,可以推出:KI3在常温下不稳定性,受热(或潮湿)条件下易分解为KI和I2 ,KI又易被空气中的氧气氧化,I2易升华,所以KI3·H2O作为食盐加碘剂是不合适的。
⑶提高加碘盐(添加KI)的稳定性,主要是防止I―被氧化,根据题给信息“还原性: >I-”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息“3I2+6OH-
>I-”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息“3I2+6OH-
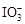 +5I-+3H2O”,可知I2与OH―会发生反应生成
+5I-+3H2O”,可知I2与OH―会发生反应生成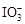 和5I-,而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化。至于AlCl3,水解后呈酸性,且还原性I~ > Cl― ,所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,所NaNO2与KI能发生氧化还原反应:2NO2-+ 2I―+ 4H+=" 2NO↑+" I2+2H2O ,不能作稳定剂。
和5I-,而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化。至于AlCl3,水解后呈酸性,且还原性I~ > Cl― ,所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,所NaNO2与KI能发生氧化还原反应:2NO2-+ 2I―+ 4H+=" 2NO↑+" I2+2H2O ,不能作稳定剂。
考点:考查物质的检验、氧化还原反应和氧化还原反应方程式、离子反应和离子反应方程式、电子式、以及实验方案的设计等化学基础知识和基本技能。


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:单选题
NaClO2可用作造纸的漂白剂,它由H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2制得,下列说法正确的是
| A.H2O2是氧化剂,H2O2中的氧元素被还原 |
| B.每生成1 mol O2转移的电子的物质的量为4 mol |
| C.ClO2中的氯元素被氧化 |
| D.ClO2是氧化剂,H2O2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物的质量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质量为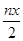 mol mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定质量的镁、铝合金与硝酸溶液恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2mol/L NaOH溶液至沉淀最多时停止加入,将所产生沉淀滤出,向滤液加水稀释至500ml,此时所得溶液物质的量浓度为
| A.0.5mol/L | B.1mol/L | C.1.2mol/L | D.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P =3P2O5+5KC1。下列有关该反应的叙述中,正确的是
| A.氯酸钾是还原剂 |
| B.反应中消耗3molP时,转移电子的物质的量为15mol |
| C.KCl既是氧化产物,又是还原产物 |
| D.发令时产生的白烟只是KC1固体颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下: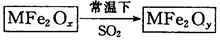
则下列判断正确的是
| A.MFe2Ox是还原剂 | B.SO2是该反应的催化剂 |
| C.x>y | D.SO2发生了置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO 3Cu+N2+3H2O,对此反应的分析合理的是( )
3Cu+N2+3H2O,对此反应的分析合理的是( )
| A.该反应属置换反应 |
| B.CuO是氧化剂 |
| C.反应体现了金属铜的还原性 |
| D.每生成1molH2O就伴随着1mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com