
【题目】下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
【答案】D
【解析】
A、由方程式可知△S>0,如反应能自发进行,则应满足△H-T△S<0,而常温下不能进行,则△H>0,故A错误;
B、醋酸为弱电解质,加水稀释促进电离,则n(CH3COOH)减小,n(CH3COO-)增大,故溶液中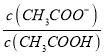 的值增大,故B错误;
的值增大,故B错误;
C、铅蓄电池在放电过程中,负极电极反应式Pb+SO42--2e-=PbSO4,负极质量减少,正极电极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O正极质量减少,故C错误;
D、长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率.水垢中含有的CaSO4,可先用Na2CO3溶液处理,CO32-与Ca2+生产更难溶的CaCO3沉淀,使CaSO4的沉淀溶解平衡向右移,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去,故D正确;
故选D。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】如图所示是某学生设计的实验室制备并干燥Cl2及吸收多余氯气的实验装置图,请回答:

(1)指出上图中的各处错误:
①____________________________________________________
②____________________________________________________
③____________________________________________________
④____________________________________________________
(2)制备实验开始时,先检查装置的气密性,接下来的操作依次是 ________
A、向烧瓶中加入MnO2粉末 B、加热 C、向烧瓶中加入浓盐酸
(3)如果将过量二氧化锰与20mL 12mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol。其主要原因有:
①____________________________________________________
②____________________________________________________
(4)为了提高浓盐酸的利用率,你对实验的建议是:
①____________________________________________________
②____________________________________________________
(5)写出圆底烧瓶中发生反应的离子反应方程式,并用单线桥表示电子转移的方向和数目________________
(6)NaClO是84消毒液的有效成分。请回答下列问题
①浸泡衣物时加入84消毒液在空气中放置一段时间漂白效果更好,结合离子方程式解释原因 ____________(已知酸性:H2CO3 >HClO>HCO3-)
②若将84消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是____________________________________________;
(7)Cl2是一种有毒气体,如果泄露会造成严重的危害。
①已知:3Cl2 + 8NH3 = 6NH4Cl +N2,化工厂可用浓氨水来检验Cl2是否泄露,该反应中被氧化和未被氧化的NH3的物质的量比________ ;
②喷射石灰乳等碱性物质可以减轻少量Cl2泄露造成的危害,Cl2与石灰乳反应的化学方程式是____________
③实验室常用烧碱溶液吸收Cl2,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合溶液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )
A. 第ⅠA族碱金属元素与ⅦA族元素所形成的化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
B. 晶体中存在阴离子就必定存在阳离子,存在阳离子就必定存在阴离子
C. 离子晶体中只含有离子键,分子晶体、原子晶体中必定含有共价键
D. C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有12个

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 新制的氯水在光照条件下颜色变浅
B. 合成氨工业中使用铁触媒作催化剂
C. 红棕色的NO2气体,加压后颜色先变深后变浅
D. 工业生产硫酸的过程中,通入过量的空气以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1.56×10-10。如图是向10 mL AgNO3溶液中逐渐加入0.1 mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B. 图中x点的坐标为(100,6)
C. 图中x点表示溶液中Ag+恰好完全沉淀
D. 把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=![]() 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
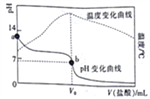
A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的溶解平衡曲线。下列有关说法正确的是

A. CaCO3(s)![]() Ca2+(aq)+ CO32-(aq) ΔH<0
Ca2+(aq)+ CO32-(aq) ΔH<0
B. a、b、c、d四点对应的溶度积Ksp相等
C. 温度不变,蒸发水,可使溶液由a点变到c点
D. 25 ℃时,CaCO3的Ksp=2.8×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是
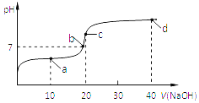
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+) = c(CH3COO-)
C. c点时:c(OH-) =c(CH3COOH) + c(H+)
D. d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 15g甲基含有的电子数为10NA
B. 1mol2,2,3-三甲基丁烷含有非极性共价键总数为23 NA
C. 14g乙烯和环丙烷的混合物所含的原子总数为6NA
D. 在常温常压下,11.2L CH3Cl的质量小于25.25g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com