
【题目】下列事实不能用勒夏特列原理解释的是
A. 新制的氯水在光照条件下颜色变浅
B. 合成氨工业中使用铁触媒作催化剂
C. 红棕色的NO2气体,加压后颜色先变深后变浅
D. 工业生产硫酸的过程中,通入过量的空气以提高二氧化硫的转化率
科目:高中化学 来源: 题型:
【题目】今有0.1mol/L Na2SO4溶液300mL,0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之比是( )
A.1:1:1
B.3:2:1
C.3:2:3
D.1:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数。(写出计算过程,最终结果保留0.1%)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用序号填空。
①35Cl和37Cl;②CH3CH2CH3和CH3CH2CH2CH3;③CH3-CH2-OH和CH3-O-CH3④
(1)互为同位素的是________;
(2)互为同分异构体的是________;
(3)互为同系物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数NA的叙述正确的是
A. 1molCl2参加反应,不一定得到2NA个电子
B. 标准状况下,将22.4LNO和11.2LO2混合后,可以得到NA个NO2分子
C. 常温常压下,1L0.1mol/LHF溶液中含有0.1NA个H+
D. 25 ℃,1.7g羟基所含电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )

A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
① | ② | ③ | ④ | |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. 分别加水稀释10倍,四种溶液的pH ①>②>④>③
C. ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
D. VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va ∶Vb= 11∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是

A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32—)+c(HCO3-)+c(H2CO3)=c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32—)>c(H2CO3)
D. 当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。

(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
【答案】 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 1s22s22p63s23p63d104s1或 3d104s1 面心立方最密堆积 O N 正四面体 sp3 高于 因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点 CuCl 
【解析】(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-; 故答案为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(2)铜是29号元素,基态原子的电子排布式为1s22s22p63s23p63d104s1,铜单质晶体中的原子堆积模型属于面心立方最密堆积,故答案为:1s22s22p63s23p63d104s1;面心立方最密堆积;
(3)上述深蓝色晶体所含的非金属元素有N、H、O、S,其中O元素的非金属性最强,电负性最大,N的2p为半充满状态,较为稳定,第一电离能最大。[Cu(NH3)4]2+形成4个配位键,具有对称的空间构型,中心原子的杂化方式为sp3,空间结构为正四面体,故答案为:O;N;正四面体;sp3;
(4)氨分子间能够形成氢键,沸点高于膦(PH3),故答案为:高于;因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点。
(5)晶胞中Cu位于顶点、面心,晶胞中Cu原子为8×![]() +6×
+6×![]() =4,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;1mol晶胞的质量为4×
=4,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;1mol晶胞的质量为4×![]() g,1mol晶胞的体积为a3 cm3,该晶体的密度为ρg·cm-3,因此a3 cm3×ρg·cm-3=4×
g,1mol晶胞的体积为a3 cm3,该晶体的密度为ρg·cm-3,因此a3 cm3×ρg·cm-3=4×![]() g,解得a=
g,解得a= cm=
cm= ×107 nm,故答案为:CuCl;
×107 nm,故答案为:CuCl;  ×107。
×107。
【题型】填空题
【结束】
12
【题目】有机物J是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:

已知:
回答下列问题:
(1)A→B的反应类型为_______________。C中的官能团名称为_____________________。
(2)D生成E的化学方程式为__________________________________。
(3)J的结构简式是_____________________。在一定条件下,H 自身缩聚生成高分子化合物的化学方程式为_______________________________________。
(4) 根据C![]()
![]() X,x的分子式为_____________________。X有多种同分异构体,其中满足下列条件的同分异构体共有___________种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
X,x的分子式为_____________________。X有多种同分异构体,其中满足下列条件的同分异构体共有___________种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无-O-O-键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以乙烯和甲苯为原料,合成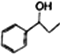 的路线流程图(其它试剂自选):__________________________________。
的路线流程图(其它试剂自选):__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com