
| ||
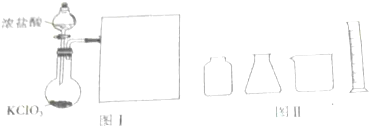
 ,仪器组装好后,首先应进行的一项操作是检验装置的气密性,
,仪器组装好后,首先应进行的一项操作是检验装置的气密性, ;检验装置的气密性;
;检验装置的气密性;
| ||
| ||


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
| A、-1 | B、+1 | C、+5 | D、+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

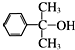 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
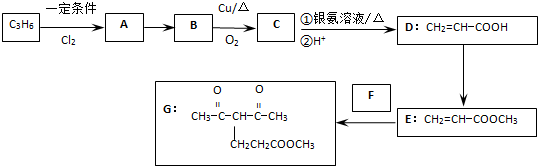

查看答案和解析>>
科目:高中化学 来源: 题型:
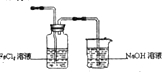
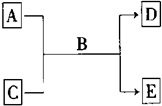 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3种 | B、4种 | C、5种 | D、6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
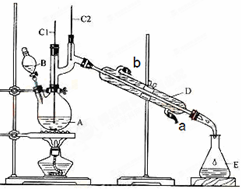 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下: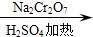 CH3CH2CH2CHO
CH3CH2CH2CHO| 沸点/℃ | 密度/(g?cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体实验装置在实验前进行气密性检查 |
| B、可燃性气体点燃前需要验纯 |
| C、实验剩余的药品不能放回原试剂瓶 |
| D、滴管不能交叉使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3、HCl |
| B、Na2CO3、HCl |
| C、NaAlO2、H2SO4 |
| D、AlCl3、NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com