
【题目】用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的立体构型,有时也能用来推测键角大小,下列判断正确的是( )
A.SO2、CS2、HI都是直线形分子B.BF3键角为120°,H2S键角大于120°
C.CH2O、BF3、SO3都是平面三角形分子D.PCl3、NH3、PCl5都是三角锥形分子
【答案】C
【解析】
将σ键电子对数和中心原子的孤电子对数相加便得到中心原子的价层电子对数,由价层电子对的相互排斥,得到含有孤电子对的VSEPR模型,然后略去孤电子对,便可得到分子的立体构型。
A.SO2中价层电子对个数为![]() ,且含1个孤电子对,VSEPR模型为平面三角形,略去孤电子对,立体构型为V形,CS2中价层电子对数为
,且含1个孤电子对,VSEPR模型为平面三角形,略去孤电子对,立体构型为V形,CS2中价层电子对数为![]() ,立体构形为直线形,HI也为直线形,A项错误;
,立体构形为直线形,HI也为直线形,A项错误;
B.BF3中价层电子对数为![]() ,VSEPR模型为平面三角形,立体构型也为平面三角形,键角为120°,H2S中价层电子对数为
,VSEPR模型为平面三角形,立体构型也为平面三角形,键角为120°,H2S中价层电子对数为![]() ,含2个孤电子对。VSEPR模型为正四面体形,略去孤电子对,立体构型为V形,H2S键角小于120°,B项错误;
,含2个孤电子对。VSEPR模型为正四面体形,略去孤电子对,立体构型为V形,H2S键角小于120°,B项错误;
C.CH2O、BF3、SO3分子中价层电子对数分别为![]() 、
、![]() 、
、![]() ,且均无孤电子对,所以CH2O、BF3、SO3均为平面三角形,C项正确;
,且均无孤电子对,所以CH2O、BF3、SO3均为平面三角形,C项正确;
D.PCl3、NH3的价层电子对数均为![]() 且含有一个孤电子对,VSEPR模型为正四面体形,略去孤电子对,立体构型为三角锥形,PCl5中价层电子对数为
且含有一个孤电子对,VSEPR模型为正四面体形,略去孤电子对,立体构型为三角锥形,PCl5中价层电子对数为![]() 且不含孤电子对,PCl5的立体构型为三角双锥形,D项错误;
且不含孤电子对,PCl5的立体构型为三角双锥形,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的Q后会发生如下反应:2Q(g) ![]() M(g) 。其中M的物质的量浓度随时间的变化如图所示。
M(g) 。其中M的物质的量浓度随时间的变化如图所示。
下列说法错误的是
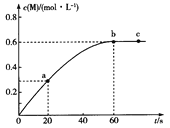
A.从反应开始到刚达到平衡时间段内,v(Q)=0.02 mol·L-1·s-1
B.a、b两时刻生成Q的速率:v(a)<v(b)
C.用Q浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0
D.其他条件相同,起始时将0. 2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气转变为甲醇过程中,涉及如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
A.在0~5min内,v(H2)=0.1 mol·L-1·min-1
B.当反应达到平衡时,CO和H2的物质的量之比为1:2
C.其他条件不变时,若将该体系换成恒温(起始温度为T)恒容密闭容器,则CO的平衡转化率将增大
D.5min后,将甲醇液化分离出,此时平衡正向移动,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组发现有机化合物A的结构如图所示:
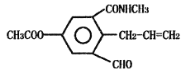
下列有关化合物A说法正确的是
A.化合物A的分子式为C14H13NO4
B.向化合物A中加入少量溴水,观察到溴水褪色,证明化合物A中含碳碳双键
C.1 mol化合物A最多可与3 mol NaOH溶液发生反应
D.化合物A可发生加成、氧化、缩聚、取代等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PHB塑料是一种可在微生物作用下降解的环保型塑料,其结构简式为![]() ,下面有关PHB的说法不正确的是( )
,下面有关PHB的说法不正确的是( )
A.PHB通过加聚反应制得
B.PHB的单体是CH3CH2CH(OH)COOH
C.PHB在微生物作用下的降解产物可能有CO2和H2O
D.PHB是一种聚酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石具有硬度大、熔点高等特点,大量用于制造钻头、金属切割刀具等。其结构如图所示,下列判断正确的是( )
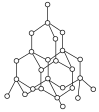
A.金刚石中C—C键的键角均为109°28′,所以金刚石和CH4的晶体类型相同
B.金刚石的熔点高与C—C键的键能无关
C.金刚石中碳原子个数与C—C键键数之比为1∶2
D.金刚石的熔点高,所以在打孔过程中不需要进行浇水冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72— 还原为Cr3+。该反应的离子反应方程式为___________________________________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
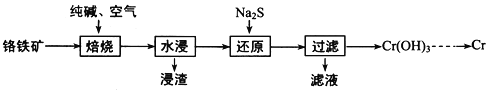
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②“水浸”要获得浸出液的操作是______。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为____。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是____。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() +H2O)。
+H2O)。
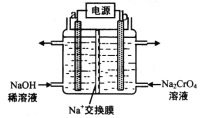
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为______。 ②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 __________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一个碳原子上连多个羟基时不稳定:![]() 。烃A有如下的转化关系:
。烃A有如下的转化关系:
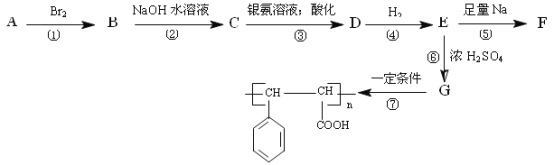
![]() 写出物质C的结构简式: ______ ,反应⑥的反应类型是 ______ 。
写出物质C的结构简式: ______ ,反应⑥的反应类型是 ______ 。
![]() 中含氧官能团的名称为 ______ ,D的核磁共振氢谱中将会出现 ______ 组吸收峰。
中含氧官能团的名称为 ______ ,D的核磁共振氢谱中将会出现 ______ 组吸收峰。
![]() 写出C与银氨溶液反应的化学方程式: ______ 。
写出C与银氨溶液反应的化学方程式: ______ 。
![]() 与G具有相同官能团的同分异构体有四种,其中两种为:
与G具有相同官能团的同分异构体有四种,其中两种为: 请写出其它两种的结构简式: ______ 、 ______ 。
请写出其它两种的结构简式: ______ 、 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡金属元素。A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的名称:A__________,C________。
(2)E元素原子的未成对电子数是________,E元素在周期表中位于第________周期______族;已知元素周期表可按电子排布分为s区、p区、d区等,则E元素在______区。
(3)画出D的核外电子排布图:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com