
【题目】合成气转变为甲醇过程中,涉及如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
A.在0~5min内,v(H2)=0.1 mol·L-1·min-1
B.当反应达到平衡时,CO和H2的物质的量之比为1:2
C.其他条件不变时,若将该体系换成恒温(起始温度为T)恒容密闭容器,则CO的平衡转化率将增大
D.5min后,将甲醇液化分离出,此时平衡正向移动,正反应速率增大
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与CH3CH2COOCH3 中均含有甲基、乙基和酯基,为同一种物质
B.![]() 和
和 ![]() 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和CH3CH2CH(CH3)2 互为同素异形体
D.CH3CH2OH 和 CH2OHCHOHCH2OH 具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发酵法制酒精的过程可粗略表示如下:
①(C6H10O5)n+n H2O![]() n C6H12O6
n C6H12O6
② C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(1)上述化学方程式中(C6H10O5)n可能表示___(填物质名称);
(2)C6H12O6名称是__,它的结构简式为___,常用____反应实验或它与氢氧化铜悬浊液的反应来检验其存在。
(3)为检验苹果成熟过程中发生了反应①,可在青苹果汁中滴加碘酒,溶液呈___色,向熟苹果汁中加入Cu(OH)2悬浊液,加热,反应生成___ (填实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的许多化合物在生产、生活中有着广泛的应用,如FeCl3是重要的金属蚀刻剂、水处理剂;影视作品拍摄中常用Fe(SCN)3溶液模拟血液;FeS可用于消除水中重金属污染等。
(1)已知:①3Cl2(g)+2Fe(s)=2FeCl3(s) ΔH1=akJ·mol-1
②2FeCl2(s)+Cl2(g)=2FeCl3(s) ΔH2=bkJ·mol-1
则2FeCl3(s)+Fe(s)=3FeCl2(s) ΔH3=____。
(2)将c(FeCl3)=0.2mol·L-1的溶液与c(KSCN)=0.5mol·L-1的溶液按等体积混合于某密闭容器发生反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
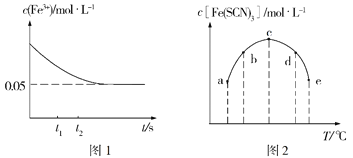
①研究表明,上述反应达到平衡后,向体系中加入适量KCl固体后,溶液颜色无变化,其原因是___,根据图1分析,在t1、t2时刻,生成Fe3+的速率较大的是____时刻。
②常温下Fe3++3SCN-![]() Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
③根据图2判断,该反应的ΔH___0(填“>”或“<”),图中五个点对应的状态中,一定处于非平衡态的是___(填对应字母)。
(3)利用FeS可除去废水中的重金属离子,如用FeS将Pb2+转化为PbS可消除Pb2+造成的污染,当转化达到平衡状态时,废水中c(Fe2+)=___c(Pb2+)[填具体数据,已知Ksp(PbS)=8×10-28,Ksp(FeS)=6×10-18]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物;②煤和石油都是可再生能源;③![]() 和
和![]() 都是电解质;④不锈钢和目前流通的硬币都是合金;⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥鸡蛋清的水溶液和雾都是胶体.上述说法正确的是( )
都是电解质;④不锈钢和目前流通的硬币都是合金;⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥鸡蛋清的水溶液和雾都是胶体.上述说法正确的是( )
A.①②④B.①⑤⑥C.②③④⑤D.①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的立体构型,有时也能用来推测键角大小,下列判断正确的是( )
A.SO2、CS2、HI都是直线形分子B.BF3键角为120°,H2S键角大于120°
C.CH2O、BF3、SO3都是平面三角形分子D.PCl3、NH3、PCl5都是三角锥形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
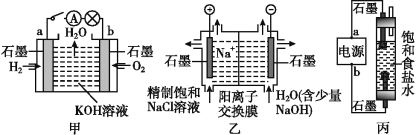
(1)甲装置中,a电极的反应式为_______________________________________。
(2)乙装置中,阴极区产物为________和_______。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_______(填“正”或“负”)极,该装置内,发生的电解方程式为___________________________________、生成消毒液的方程式为________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为___________(不考虑气体的溶解)。
(5)某工厂采用电解法处理含Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为Cr3+,Cr3+在阴极区生成Cr(OH)3沉淀除去,工作原理如图:
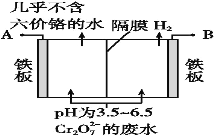
①写出电解时阳极的电极反应式:______________________________________。
②写出Cr2O72-被还原为Cr3+的离子方程式:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com