
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72— 还原为Cr3+。该反应的离子反应方程式为___________________________________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
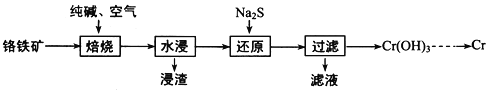
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②“水浸”要获得浸出液的操作是______。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为____。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是____。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() +H2O)。
+H2O)。
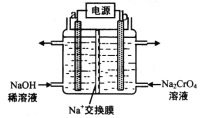
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为______。 ②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 __________mol。
【答案】3SO32+Cr2O72+8H+=2Cr3++3SO42+4H2O 洛铁矿粉碎等 过滤 8CrO42+3S2+20H2O=8Cr(OH)3↓+3SO42+16OH CO高温还原Cr2O3(或热还原法) 正 2H2O4e=O2↑+4H+ ![]()
【解析】
(1)Na2SO3将Cr2O72-还原为Cr3+,则SO32-被氧化为SO42-,结合电荷守恒和质量守恒可得;
(2)根据流程:铬铁矿(FeOCr2O3)加入纯碱、通入空气焙烧,得到Na2CrO4,过滤,滤液含有Na2CrO4,加入Na2S还原得到Cr(OH)3,反应为:8CrO42-+3S2-+20H2O=8Cr(OH)3↓+3SO42-+16OH-,加热Cr(OH)3可得到Cr2O3,再用还原剂还原得到Cr,据此分析作答;
(3)①b极得到Na2Cr2O7,则b有反应2CrO42-+2H+Cr2O72-+H2O,故b的电极反应为水放电生成氧气和氢离子,据此可得;
②根据电荷守恒计算。
(1)Na2SO3将Cr2O72还原为Cr3+,则SO32被氧化为SO42,离子反应为:3SO32+Cr2O72+8H+=2Cr3++3SO42+4H2O,故答案为:3SO32+Cr2O72+8H+=2Cr3++3SO42+4H2O;
(2)①将洛铁矿粉碎等可以加快焙烧速率和提高原料的利用率,故答案为:将洛铁矿粉碎等;
②根据流程,水浸得到浸渣和浸取液,分离固液的操作是过滤;浸出液的主要成分为Na2CrO4,加入Na2S还原得到Cr(OH)3,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则有SO42,故反应为:8CrO42+3S2+20H2O=8Cr(OH)3↓+3SO42+16OH,故答案为:过滤;8CrO42+3S2+20H2O=8Cr(OH)3↓+3SO42+16OH;
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是用CO高温还原Cr2O3(或热还原法),故答案为:CO高温还原Cr2O3(或热还原法);
(3)①b极得到Na2Cr2O7,则b有反应2CrO42+2H+Cr2O72+H2O,故b的电极反应为水放电生成氧气和氢离子,反应为:2H2O4e=O2↑+4H+,故b极为阳极,连接电源正极,故答案为:正;2H2O4e=O2↑+4H+;
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则溶液中移动的电荷为(ab)mol,所以外电路中转移的电子为(ab)mol,阳极的电极反应为:2H2O4e=O2↑+4H+,则阳极生成的氢离子为(ab)mol,已知:2CrO42+2H+Cr2O72+H2O,则则理论上生成重铬酸钠的物质的量是![]() mol,故答案为:
mol,故答案为:![]() 。
。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物;②煤和石油都是可再生能源;③![]() 和
和![]() 都是电解质;④不锈钢和目前流通的硬币都是合金;⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥鸡蛋清的水溶液和雾都是胶体.上述说法正确的是( )
都是电解质;④不锈钢和目前流通的硬币都是合金;⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥鸡蛋清的水溶液和雾都是胶体.上述说法正确的是( )
A.①②④B.①⑤⑥C.②③④⑤D.①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的立体构型,有时也能用来推测键角大小,下列判断正确的是( )
A.SO2、CS2、HI都是直线形分子B.BF3键角为120°,H2S键角大于120°
C.CH2O、BF3、SO3都是平面三角形分子D.PCl3、NH3、PCl5都是三角锥形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2;②KClO3+6HCl=3Cl2↑+KCl+3H2O;③2KBrO3+Cl2=Br2+2KClO3。下列说法正确的是:( )
A.①中KCl 是氧化产物,KBr发生还原反应
B.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C.反应②中氧化剂与还原剂的物质的量之比为1:6
D.③中1 mol氧化剂参加反应得到电子的物质的量为2.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
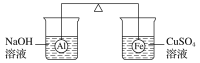
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是合成治疗恶心、呕吐药物--盐酸阿扎司琼的一种中间体,其合成路线如下:
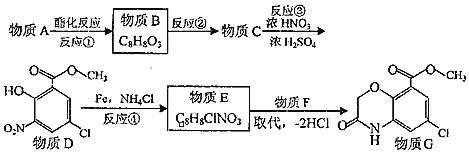
回答下列问题:
![]() 物质G在核磁共振氢谱中显示有 ______ 种不同化学环境的氢原子,其个数比为: ______ 。
物质G在核磁共振氢谱中显示有 ______ 种不同化学环境的氢原子,其个数比为: ______ 。
![]() 写出物质C、F的结构简式: ______ 、 ______ 。
写出物质C、F的结构简式: ______ 、 ______ 。
![]() 指出反应
指出反应![]() 的反应类型: ______ 。
的反应类型: ______ 。
![]() 写出反应
写出反应![]() 的化学方程式 ______ 。
的化学方程式 ______ 。
![]() 实际生产过程中D的产率较低。请从C的结构特点及反应条件分析原因并提出改进措施: ______ 。
实际生产过程中D的产率较低。请从C的结构特点及反应条件分析原因并提出改进措施: ______ 。
![]() 写出两种满足下列条件的有机物结构简式: ______ 、 ______ 。
写出两种满足下列条件的有机物结构简式: ______ 、 ______ 。
![]() 分子组成比D少一个氧原子
分子组成比D少一个氧原子
![]() 苯环上的一氯代物只有一种
苯环上的一氯代物只有一种
![]() 该物质最多可以和含
该物质最多可以和含![]() 的溶液反应
的溶液反应![]() 不考虑苯环上卤原子的水解
不考虑苯环上卤原子的水解![]()
![]() 不能使
不能使![]() 溶液显紫色。
溶液显紫色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
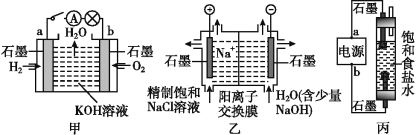
(1)甲装置中,a电极的反应式为_______________________________________。
(2)乙装置中,阴极区产物为________和_______。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_______(填“正”或“负”)极,该装置内,发生的电解方程式为___________________________________、生成消毒液的方程式为________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为___________(不考虑气体的溶解)。
(5)某工厂采用电解法处理含Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为Cr3+,Cr3+在阴极区生成Cr(OH)3沉淀除去,工作原理如图:
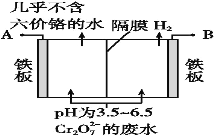
①写出电解时阳极的电极反应式:______________________________________。
②写出Cr2O72-被还原为Cr3+的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置图的叙述中正确的是
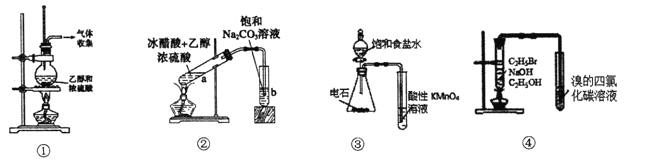
A. 装置①:实验室制取乙烯
B. 装置②:实验室制取乙酸乙酯
C. 装置③:验证乙炔的还原性
D. 装置④:验证溴乙烷发生消去反应可生成烯烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com