
【题目】废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJmol﹣1
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 .
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是 .
【答案】
(1)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol
(2)温度升高,H2O2分解速率加快
(3)2Cu2++SO32﹣+2Cl﹣+H2O ![]() 2CuCl↓+SO42﹣+2H+;
2CuCl↓+SO42﹣+2H+;
【解析】解:(1)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H=﹣285.84kJ/mol
依据盖斯定律①+ ![]() ②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol;
②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol;
(2)双氧水不稳定,温度高易分解,温度高于40℃时,双氧水分解速率加快,氧化铜的浓度就降低,所以铜的平均溶解速率随着反应温度升高而下降;
(3)根据题干信息,可知发生的反应为2Cu2++SO32﹣+2Cl﹣+H2O ![]() 2CuCl↓+SO42﹣+2H+;
2CuCl↓+SO42﹣+2H+;
故答案为:(1)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol;(2)温度升高,H2O2分解速率加快;(3)2Cu2++SO32﹣+2Cl﹣+H2O △ _ 2CuCl↓+SO42﹣+2H+.
(1)根据盖斯定律计算目标方程的反应热,从而写出反应的热化学方程式;
(2)温度过高,过氧化氢不稳定,易分解,导致反应物浓度降低;
(3)由题干确定反应物、生成物;再根据得失电子守恒进行方程式的配平。


科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究. 请回答:
Ⅰ.用图 1 所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是(填字母序号).
(2)N 极发生反应的电极反应式为 . Ⅱ.用图 2 所示装置进行第二组实验.实验过程中,观察到与第一组实验不同的现象:两极 均有气体产生,Y 极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清. 查阅资料得知,高铁酸根离子(FeO42﹣)在溶液中呈紫红色.
(3)电解过程中,X 极区溶液的 pH(填“增大”“减小”或“不变”).
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣═Fe4O2﹣+4H2O 若在 X 极收集到672mL 气体,在 Y 极收集到 168mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁 电极)质量减少g.
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 . 该电池正极发生的反应的电极反应式为 . 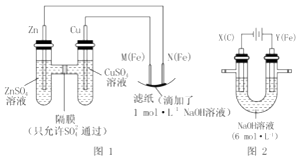
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是
A. 铁与氯化铁溶液:2Fe3++ Fe ![]() 3Fe2+
3Fe2+
B. 碳酸钙与盐酸:CO32-+ 2H+![]() CO2↑+ H2O
CO2↑+ H2O
C. 二氧化硅与氢氧化钠溶液:SiO2 + 2OH-![]() SiO32-+ H2O
SiO32-+ H2O
D. 铜与稀硝酸:3Cu + 8H++ 2NO3-![]() 3Cu2+ + 2NO↑+ 4H2O
3Cu2+ + 2NO↑+ 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。种制取Cl2O 的装置如图所示。
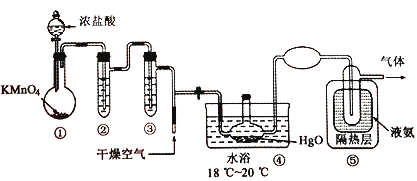
已知:C12O的熔点为-116℃,沸点为3.8℃,Cl2 的沸点为-34.6℃;HgO+2Cl2=HgCl2 +Cl2O
下列说法不正确的是
A. 装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B. 通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C. 从装置⑤中逸出气体的主要成分是Cl2O
D. 装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期表及元素周期律,下列推断正确的是
A. 碱性:Ca(OH)2 >Mg(OH)2 B. 酸性:H2SO3 > H2CO3
C. 热稳定性:NH3 < PH3 D. 还原性:S2- < F-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2会形成酸雨,危害环境。某化学实验小组用如下装置进行有关SO2性质的探究活动。
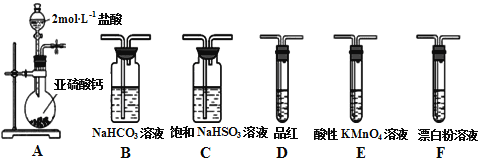
(1)装置A中反应的离子方程式为___________________________________。
(2)选用以上装置和药品探究亚硫酸与次氯酸的酸性强弱:甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明,乙同学认为该方案不合理,其理由是___________________。正确的连接顺序是:A→C→___________→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是__________________________。
(3)将二氧化硫通入以下装置可以制备Na2S2O3:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是________________。
②写出装置A中发生反应的化学方程式___________________________________。
③Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=____mol·L-1。(已知:IO3-+5I-+6H+= 3I2+3H2O, 2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的 NH3 和 Cl2 在常温下可合成岩脑砂(主要成分为 NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
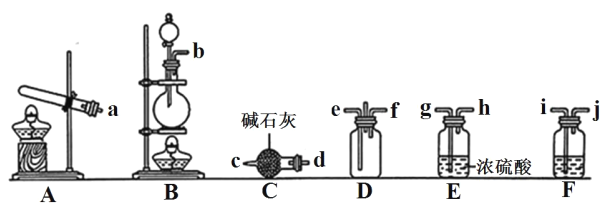
①利用装置 A 制取实验所需的 NH3,写出反应的化学方程式:_______。
②已知该实验中用浓盐酸与 MnO2 反应制取所需 Cl2,装罝 F中的试剂是饱和食盐水,则 F装置的作用是_______。
③为了使NH3和Cl2在D中充分混合,请确定上述装置的合理连接顺序:_______→e f←_______(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明NH3和Cl2反应有岩脑砂生成,需要用到的实验用品中除了蒸馏水、稀 HNO3、 红色石蕊试纸外,还需要用到的试剂有_______。(填试剂的化学式)
(2)岩脑砂中元素的测定
准确称取 a g 岩脑砂,与足量的氧化铜混合加热,利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。(已知该过程发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O)
3Cu+N2↑+2HCl↑+3H2O)
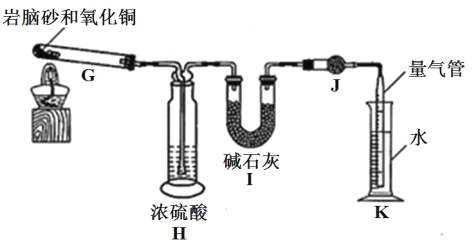
⑤设置装置 H 的目的是______。
⑥若装置 I 增重 b g,利用装置 K 测得气体体积为 V L(已知常温常压下的气体摩尔体积为 24.5L·mol-1),则岩脑砂中 n(N):n(Cl)= ______(用含 b、V的代数式表示,不必化简)。
⑦若测量体积时气体温度高于常温(其他操作均正确),则 n(N)比正常值______ (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com