
【题目】化学与生活、社会密切相关。下列有关说法正确的是
A. 在人体内酶的作用下,纤维素可以发生水解生成葡萄糖
B. 福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜
C. 新型材料聚酯纤维、光导纤维都属于有机高分子材料
D. 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】与链烃相比,苯的化学性质的主要特征为 ( )
A. 难氧化、难取代、难加成 B. 易氧化、易取代、易加成
C. 难氧化、易取代、难加成 D. 易氧化、易取代、难加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法命名:
①(CH3)2CH(CH2)2CH(C2H5) (CH2)2(CH3)的名称:_________________。
② 的名称:________________。
的名称:________________。
(2)溴乙烷发生消去反应的化学方程式:____________________________。
(3)乙醛发生银镜反应的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当Mg(OH)2在水中达到溶解平衡时:Mg(OH)2(s)Mg2+(aq)+2OH﹣(aq)要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是
A.NH4Cl B.NaOH C.Na2CO3 D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g) + O2(g) ![]() 2SO3(g) + Q
2SO3(g) + Q ![]()
(1)若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
|
| 平衡常数K |
________ | ________ | ________ |
(2)2SO2(g) + O2(g) ![]() 2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
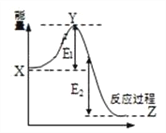
A.加入催化剂,X点位置升高
B.反应热 = E1 + E2
C.反应物总能量低于生成物
D.加入催化剂,E2不变
(3)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
实验1从开始到反应达到化学平衡时,用去时间2分钟,则υ(SO2)表示的反应速率为_________;T1________T2(填“>”、“<”或“=”)。制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
(4)0.1mol/L的NaHSO3溶液中c(H+) > c(OH-),用水解和电离理论的角度解释其原因___________________;若往溶液中加入氨水至中性,则c(Na+)______c(HSO3-) + c(SO32-) + c(H2SO3)(填“>”、“﹤”或“=”)。
(5)往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-)的比值____________(填“变大”、“变小”或“保持不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟合成硫酸的流程如下:

从下图中选择制取气体的合适装置:

(1)装置C的名称为__________,实验室通常用装置C制备_____。
A.H2 B.C2H2 C.CO2 D.NH3
(2)实验室用装置D制备O2的化学方程式为____________________。
(3)若用装置B制备SO2,可以选用试剂为_____。
A.浓硫酸、亚硫酸钠固体 B.浓硫酸、铜片
C.稀硫酸、亚硫酸钠溶液 D.浓硫酸、铁屑
(4)SO2和O2通过甲装置,甲装置的作用除了可以控制SO2、O2的流速外,还可以__________、__________。

(5)使用乙处导出的有关气体制成硫酸,下列a、b、c三套装置中你选择的是_______,该套装置与其它装置比较,其优点是___________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出制取硝基苯的化学反应方程式_________________________________;
(2)写出镁铝氢氧化钠原电池的负极电极反应式___________________________;
(3)氯气是重要的化工原料,可以用来制备很多化工产品,比如可以制备净水剂高铁酸钾(K2FeO4),写出碱性条件下,由氯化铁制备高铁酸钾的离子方程式___________;
写出工业制漂白粉的化学反应方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等.则己反应的Fe3+和未反应的Fe3+的物质的量之比是
A.2:3 B.3:2 C.1:2 D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子数不同的CO与N2的体积一定不等
B.体积相同的CO与N2的质量一定相等
C.质量不同、密度相同的CO与N2所含分子数可能相同
D.质量相同、密度不同的CO与N2所含的原子数目一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com