
【题目】将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
A. 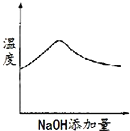 B.
B. 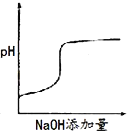 C.
C. 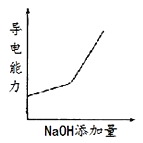 D.
D. 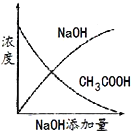
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列说法一定正确的是( )

A.一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+
B.一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+
C.溶液中c(H+):c(Al3+):c(Mg2+)=1:1:2
D.溶液中c(H+)/c(SO42-)![]() 2/9
2/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的数值。下列说法正确的是
为阿伏加德罗常数的数值。下列说法正确的是
A. ![]() 中含有的中子数为
中含有的中子数为![]()
B. ![]() 分子式为
分子式为![]() 的有机物中含有的
的有机物中含有的![]() 键的数目一定为
键的数目一定为![]()
C. 标准状况下,![]() 所含原子数为
所含原子数为![]()
D. 密闭容器中![]() 与
与![]() 充分反应,生成的
充分反应,生成的![]() 分子数等于
分子数等于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应2H2O2![]() 2H2O+O2↑可制备氧气。
2H2O+O2↑可制备氧气。
① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的___(填“深”或“浅”),其原因是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
某化学小组根据上述反应原理进行下列实验:
Ⅰ.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol·L-1KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会________(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为________。
(4)计算H2C2O4溶液的物质的量浓度为________mol·L-1。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1mol·L-1KMnO4溶液 | 0.1mol·L-1H2C2 O4溶液 | 0.1mol·L-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中V1=________,V2=________。
(6)实验中需要测量的数据是________。
(7)实验中________(填“能”或“不能”)用0.2mol·L-1盐酸代替0.1mol·L-1H2SO4溶液,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“ 0”或“0”刻度线稍下,并记下读数;④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴甲基橙溶液;⑤用标准液滴定至终点,记下滴定管液面读数。⑥重复以上滴定操作2-3次。请回答:
(1)以上步骤有错误的是(填编号)____________________
(2)步骤④中,量取20.00 mL待测液应使用_________________(填仪器名称)
(3)步骤⑤滴定时眼睛应注视______________________________;判断到达滴定终点的依据是:______________________________________。
(4)以下是实验数据记录表
滴定 次数 | 盐酸体积 (mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.20 |
3 | 20.00 | 0.00 | 16.16 |
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是__________
A. 锥形瓶装液前,留有少量蒸馏水 B. 滴定结束时,仰视读数
C.滴定前滴定管尖嘴无气泡,滴定结束有气泡 D.锥形瓶用待测液润洗
E. NaOH标准液保存时间过长,有部分变质
(5)根据表中记录数据,通过计算可得,该盐酸浓度为: ____________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:b. ___________。
(2)仪器c使用前必须_________________。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是_________。
(4)用质量分数为98%、密度为1.84 g/cm3的浓H2SO4来配制480 mL、0.3 mol·L-1的稀H2SO4。
①装置Ⅱ是某同学转移溶液的示意图,图中的错误是_____________________。除了图中给出的的仪器外,为完成实验还需要的仪器有:___________________。
②根据计算得知,需量取该浓H2SO4的体积为_______________mL。
(5)下列操作,会使所配制的溶液浓度偏大的是____________。
①容量瓶中原来含有少量蒸馏水;
②在未降至室温时,立即将溶液转移至容量瓶定容
③定容转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度
④定容时俯视刻度线;
⑤用量筒量取98%的硫酸时俯视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com