
【题目】关于下列各实验装置的叙述中,不正确的是 ( )
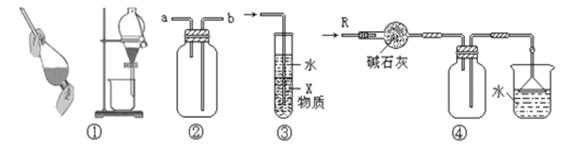
A. 装置①可用于分离酒精和水的混合物
B. 装置②可用于收集NH3、Cl2、SO2、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家用![]() 和
和![]() 两种核素精确测定了地球和月球的年龄,得出月球至少比地球早700万年形成,下列有关
两种核素精确测定了地球和月球的年龄,得出月球至少比地球早700万年形成,下列有关![]() 和
和![]() 的说法正确的是 ( )
的说法正确的是 ( )
A. 互为同位素 B. 原子质量几乎相等
C. 中子数相等 D. 在周期表中处于相邻位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是 ![]() 和
和 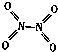 .实验测得N﹣N键的键能为167kJmol﹣1 , NO2中氮氧键的键能为 466kJmol﹣1 , N2O4中氮氧键的键能为438.5kJmol﹣1 .
.实验测得N﹣N键的键能为167kJmol﹣1 , NO2中氮氧键的键能为 466kJmol﹣1 , N2O4中氮氧键的键能为438.5kJmol﹣1 .
(1)写出N2O4转化NO2为的热化学方程式 .
(2)对反应N2O4(g)2NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.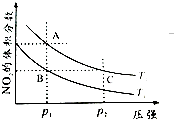
①A、C两点的反应速率v(A)v(C)(填“>”“=”或“<”).
②B、C两点的气体平均相对分子质量M(B)M(C)(填“>”、“=”或“<”).
③由状态B到达状态A可用的方法是 .
④A点气体的颜色比C点(填“深”、“浅”或“相同”),原因是 .
(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据.
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20s时,v(NO2)=molL﹣1s﹣1 .
②若在相同的情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度应是molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”这里的“石碱”是指( )
A.KOHB.KAl(SO4)2
C.KHCO3D.K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图如右图所示: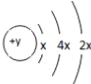 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为_______,其气态氢化物的化学式为________。
(2)D离子的离子结构示意图为__________________。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为_______________________(用元素符号比较)
(4)B的最高价氧化物的水化物与A的氢化物的水溶液反应的离子方程式式为:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2,并进行相关探究活动。
(已知:酸性强弱为H2SO3>H2CO3>HClO)
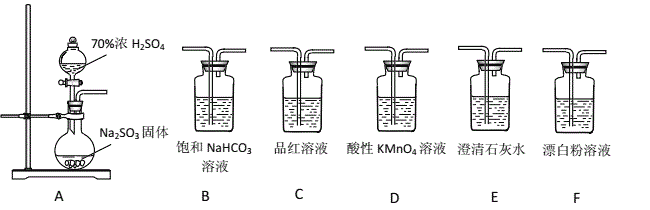
(1)装置A中反应的化学方程式为_________________________________________。
(2)甲同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到了C、D装置。
①C装置的作用是___________________________。
②通过___________________________________________________(填实验现象)即可证明亚硫酸酸性强于碳酸。
(3)乙同学认为利用上述装置也可以证明亚硫酸的酸性强于次氯酸,请写出正确的装置连接顺序:A→( )→( ) → C → F 。____________
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。
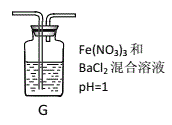
I.推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3-氧化;
原因二:SO2被Fe3+氧化;
原因三:_____________________________________________。
II.如果丙同学认为是因为“原因二”产生了白色沉淀。
①请你写出SO2被Fe3+氧化的离子方程式:_________________________________
②假如Fe3+恰好完全反应,请你设计实验证明其还原产物,并简要叙述实验过程、现象及结论。
___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将H2和I2各1mol的气态混合物充入1L的密闭容器中,发生反应:H2(g)+I2(g)2HI(g)△H<0;5min后达到平衡状态,测得c(H2)=0.9molL﹣1 , 则下列结论中,不能成立的是( )
A.平衡时H2、I2的转化率相等
B.从反应开始至平衡的过程中,v(HI)=0.04molL﹣1min﹣1
C.其他条件不变再向容器中充入少量H2 , I2的转化率提高
D.若将容器温度提高,其平衡常数K一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com