
【题目】下列实验能获得成功的是
A. 苯与浓溴水用铁作催化剂制溴苯B. 可用分液漏斗分离硝基苯和水
C. 将苯与浓硝酸混合共热制硝基苯D. 加入水后分液可除去溴苯中的溴
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】有关下列图象的分析错误的是( )
A. 图可表示对平衡N2(g)+3H2(g)2NH3(g)加压、同时移除部分NH3时的速率变化
图可表示对平衡N2(g)+3H2(g)2NH3(g)加压、同时移除部分NH3时的速率变化
B.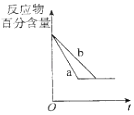 图中a、b曲线只可表示反应H2(g)十I2(g)2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
图中a、b曲线只可表示反应H2(g)十I2(g)2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
C. 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
D. 图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b
图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁的叙述中,不正确的是( )
A.铁具有良好的延展性、导电性、导热性
B.铁的化学性质非常不活泼
C.在化学反应中,铁能生成+2价或+3价的化合物
D.铁是钢的主要成份,钢铁是主要的金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0
C.常温下,NH4Cl溶液加水稀释, ![]() 增大
增大
D.C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时;向2.0L恒容密闭容器中充入1.0mol PCl5;反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s的平均速率v(PCl3)=0.003 2 molL﹣1s﹣1
B.保持其他条件不变;升高温度;平衡时c(PCl3)=0.11 molL﹣1;则反应的△H<0
C.相同温度下;起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2;反应达到平衡前v(正)>v(逆)
D.相同温度下;起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2;达到平衡时;PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Cr2O3样品中含有少量Al2O3、MgO等杂质.实验室以此样品为主要原料制取重铬酸钾(K2Cr2O7)的流程如下: 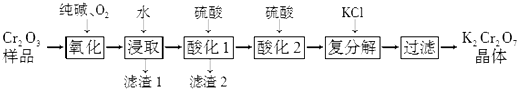
已知:2CrO42﹣+2H+Cr2O72﹣+H2O.
(1)上述氧化过程中,若将1mol Cr2O3转化成Na2CrO4 , 消耗氧气的体积(标准状况)是 .
(2)酸化1中为确保溶液中Al3+、AlO2﹣浓度均不超过10﹣6 molL﹣1 , 需调节溶液pH的范围是 . 已知:Al(OH)3(s)H++AlO2﹣+H2O的K=1×10﹣14;Ksp[Al(OH)3]=1×10﹣33
(3)酸化2后所得溶液加入KCl发生复分解反应,该反应能发生的原因是 .
(4)称取重铬酸钾试样2.40g 配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24molL﹣1 Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32﹣═2I﹣+S4O62﹣ , 杂质不参与反应),共用去Na2S2O3标准溶液20.00mL.求所得产品中重铬酸钾的质量分数(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+、Fe3+ |
可能大量含有的阴离子 | Cl-、NO3-、SO42-、CO32-、AlO2- |
为探究其成分,进行了探究实验。取一定量的溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示:

(1)该溶液中一定不存在的阳离子是_____________
(2)该溶液中一定不存在的阴离子是_____________
(3)该溶液中含有的阳离子其对应的物质的量浓度之比为____________________________
(4)写出沉淀减少过程中发生反应的离子方程式____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com