
����Ŀ��Ϊ��̽�����������ķ�Ӧ��ijͬѧ����������µ�ʵ�鷽������ʵ��װ��Ϊ��
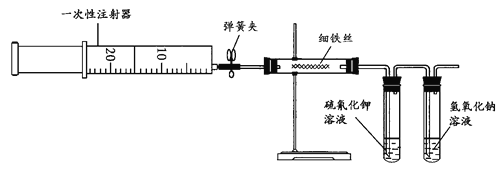
��ʵ�鲽��Ϊ��
(1)��ע������ȡ20 mL���ҵ�������
(2)��Ӳ�ʲ������ڼ���һ������ϸ��˿��һ֧�Թ��ڼ������軯����Һ����һ֧�Թ��м�������������Һ����ͼ��ʾ����ʵ��װ�ã����̶�������̨�ϡ�������װ�ò�©����
(3)����Ӳ�ʲ���������˿Լ1 min��Ȼ���ע�����е�����ע�뵽Ӳ�ʲ������ڣ��۲�ʵ�����ɹ۲쵽����Ҫ������____________�� ____________��
(4)����������Һ��������_____________��
(5)ijͬѧ��һС���������Ƭ��ȫ�������������ᣬ��������Һ���Ǻ���Fe2+���Ǻ���Fe3+��ͬѧ�������ͬ��������һλͬѧ���������ֻ��Fe2+����Fe3+������Ϊ���IJ��������_________ ������ѡҩƷ���ʵ����֤���IJ���(д������������ͽ���)____________��
���𰸡���˿����ȼ�� �����ػ�ɫ���� ����β��Cl2����ֹ��Ⱦ���� ���� ȡ������Һ�������Թ��У��μ�KSCN��Һ������Һ��ɫ�����Ա仯�����֤����Һ����Fe3+��ֻ��Fe2+
��������
Ϊ��̽�����������ķ�Ӧ����ע�����е���������װ��ϸ��˿��Ӳ�ʲ������У��ڼ��������·�����Ӧ�����ػ�ɫ��FeCl3��FeCl3�е�Ƚϵͣ����ܻ����װ�����軯����Һ���Թ��У�ʹ��Һ��죬������������������������Һ�У�������������Һ���գ���ֹ��Ⱦ������
(5)һС���������Ƭ��ȫ�������������ᣬ�������Ҫ�ɷ���Fe2O3�������ᷴӦ����FeCl3�������Ժ�FeCl3��Ӧ����FeCl2��ʣ����������ᷴӦҲ���Եõ�FeCl2����Һ�п��ܼ���Fe2+��Ҳ��Fe3+��Ҳ����ֻ��Fe2+��Fe3+������KSCN��Һ���顣
(3)�ڼ��������£������������ҷ�Ӧ�����ػ�ɫ�����غ�ɫ����FeCl3���ɹ۲쵽����Ҫ��������˿����ȼ�գ������ػ�ɫ���̡�
(4)����������Һ������������β��Cl2����ֹ��Ⱦ�����������ķ�ӦΪ��Cl2+2NaOH=NaCl+NaClO+H2O���ʴ�Ϊ������β��Cl2����ֹ��Ⱦ������
(5)�����Ϸ�����֪���������Ƭ��ȫ�������������ᣬ������Һ�п��ܼȺ���Fe2+���ֺ���Fe3+��������Ƚ��٣����ɵ�Fe3+�Ƚ��٣��������������ɵ�Fe3+ȫ����ԭΪFe2+������Ҳ����ֻ����Fe2+����Ҫ֤��ֻ��Fe2+����Fe3+��ֻ�������Fe3+���ɣ�����Fe3+������Ԫ��ֻ��Fe2+�Ե���ʽ���ڡ�������KSCN����Fe3+���ʴ�Ϊ�����ܣ�ȡ������Һ�������Թ��У��μ�KSCN��Һ������Һ��ɫ�����Ա仯�����֤����Һ����Fe3+��ֻ��Fe2+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����14�֣��屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�
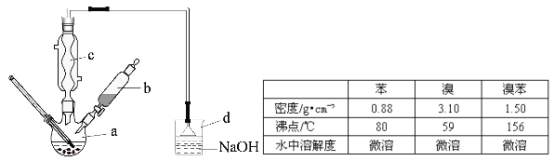
�����кϳɲ���ش����⣺
��1����a�м���15mL��ˮ����������м����b��С�ļ���4.0mLҺ̬�壬��a�е��뼸���壬�а�ɫ��������������Ϊ������ ���塣�����μ���Һ����꣬װ��d�������� ��
��2��Һ�����������в�������ᴿ��
����a�м���10mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10mLˮ��8mL10%��NaOH��Һ��10mLˮϴ�ӡ�NaOH��Һϴ�ӵ������� ����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˣ������Ȼ��Ƶ��� ��
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ ��Ҫ��һ���ᴿ�����в����б������ (������ȷѡ��ǰ����ĸ)��
A.�ؽᾧ B.���� C.���� D.��ȡ
��4���ڸ�ʵ���У�a���ݻ����ʺϵ��� (������ȷѡ��ǰ����ĸ)��
A.25mL B. 50mL C.250mL D.500mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�m g����A��n g����B�ķ�������ͬ������˵���в���ȷ����
A. ��������A��B����Է�������֮��Ϊm��n
B. ͬ��������A��B�ķ�����֮��Ϊn��m
C. ͬ��ͬѹ�£�A��B��������ܶ�֮��Ϊn��m
D. ��ͬ״���£�ͬ���A��B�����������֮��Ϊm��n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��ͼ�ش�����(װ��ͼ�÷��ű�ʾ)��

(1)˫��ˮ(H2O2)����ɫҺ�壬�ɷ������»�ѧ��Ӧ��![]() ����Ӧ��MnO2��������________����ʵ�������ô˷�Ӧ��ȡ����ʱ��Ӧѡ�õ����巢��װ����________��������鱾װ�������Եķ�����______________________________________________��
����Ӧ��MnO2��������________����ʵ�������ô˷�Ӧ��ȡ����ʱ��Ӧѡ�õ����巢��װ����________��������鱾װ�������Եķ�����______________________________________________��
(2)KClO3��MnO2������ʱ������Ҳ�����Ƶ�������Ӧѡ�õ����巢��װ����________��
(3)Ϊ����֤MnO2��KClO3�ֽ���������˴������ã�����Ҫ�ѷ�Ӧ��IJ�����룬��ȡ��MnO2����֤���ȷ�Ǵ����������MnO2�IJ�����________��________��ϴ�ӡ���ɡ�������Ϊ֤��MnO2�Ǵ���������Ҫ֪����һ��������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������һ���Ż��������ijЩҽҩ���м��壬����ͨ����ͼ��Ӧ�Ƶã������й�˵����ȷ����

A.�ҷ���������̼ԭ�ӿ��ܴ���ͬһƽ����
B.�ҿ���H2�����ʵ���֮��1��2�����ӳɷ�Ӧ
C.����һ����֬���ܷ���������Ӧ
D.�ͱ�����ʹ��ˮ��ɫ����ԭ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ������н��еĿ��淴Ӧ��aA��g����bB��g��![]() cC��g���ڲ�ͬ�¶���T1��T2����ѹǿ��p1��p2���£����������B����������w��B���뷴Ӧʱ����t���Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����
cC��g���ڲ�ͬ�¶���T1��T2����ѹǿ��p1��p2���£����������B����������w��B���뷴Ӧʱ����t���Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����

A��T1<T2��p1<p2��a��b>c������ӦΪ���ȷ�Ӧ
B��T1>T2��p1<p2��a��b<c������ӦΪ���ȷ�Ӧ
C��T1<T2��p1>p2��a��b<c������ӦΪ���ȷ�Ӧ
D��T1>T2��p1>p2��a��b>c������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a��b��c��d�ĸ������缫���йصķ�Ӧװ�ü����ַ�Ӧ�������£�
ʵ��װ�� | ����ʵ������ |
| a����������b���������� |
| b�������������c���ޱ仯 |
| d���ܽ⣬c����������� |
| ������ָʾ�ڵ����е�����a������d�� |
�ɴ˿��ж������ֽ����Ļ��˳���ǣ���������
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭпԭ�����(����ͼ)��

������ͭΪ�������Һ��пΪ________�����缫�Ϸ�������________(����������������ԭ��)��Ӧ���缫��ӦʽΪ_______________________________��пƬ�Ϲ۲쵽������Ϊ_______��
ͭΪ________�����缫�Ϸ�������________(����������������ԭ��)��Ӧ���缫��Ӧʽ��____��
ͭƬ�Ϲ۲쵽��������_______________��ԭ����ܷ�Ӧ�����ӷ���ʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ�ڹ�ũҵ����������Ҫ�����á���ҵ������þ��(��Ҫ�ɷ�ΪMgCO3��������FeCO3��SiO2��)Ϊԭ���Ʊ�����þ��������ͼ��

��1����������ʱMgCO3������Ӧ�����ӷ���ʽΪ___��
��2�������ijɷ���___(�ѧʽ)��
��3������H2O2����ʱ��������Ӧ�����ӷ���ʽΪ___��
��4��������þ��ľ̿��800��ʱ���գ����Եõ��ߴ��ȵ�MgO�����չ����д������·�Ӧ��
2MgSO4��C![]() 2MgO��2SO2����CO2��
2MgO��2SO2����CO2��
MgSO4��3C![]() MgO��S����3CO��
MgO��S����3CO��
������ͼװ�ö����ղ�����������зֲ��ռ������ջ�����

��װ��A��U�ܷ�����ˮ�е�Ŀ����___���ռ���������___��
��װ��B��C����ʢ�ŵ��Լ��ֱ���___��___���ѧʽ����
��װ��D��������___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com