
【题目】胡椒粉是植物挥发油的成分之一。它的结构简式为![]() ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )
A. 该有机物分子式为C9H10O
B. 1mol胡椒粉最多可与1mol溴水发生反应
C. 1mol胡椒粉最多可与4mol氢气发生反应
D. 胡椒粉可与FeCl3 溶液显紫色
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用下图装置进行实验,K接N,试回答:
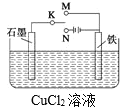
(1)石墨极为______极(填“正”、“负”、“阳” 或“阴”),铁极上的电极反应为:_______。电池总反应为:________。Cu2+向____(填“石墨”或“铁”)电极移动。
(2)若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
A.达到平衡时,4v(O2)正=5v(NO)逆
B.达到平衡状态后,NH3 、O2 、NO 、H2O(g)的物质的量保持不变。
C.达到平衡状态时,若增加容器体积,则反应速率增大
D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新型冠状病毒疫情中常用84消毒液进行消毒,有效成分为NaClO溶液,其主要是基于次氯酸(HClO)的氧化性。氯所在的卤族元素在生产生活中有广泛应用,回答以下问题:
(1)基态氯原子的核外价电子排布式为__________,HClO分子中中心原子的杂化轨道类型为__________。
(2)生产农药的原料PSCl3中,P、S、Cl的电负性由大到小的顺序为_________。
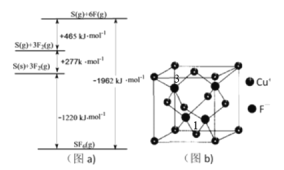
(3)①与Cl相邻的元案S、F,其化化物SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能,则S-F键的键能为__________。
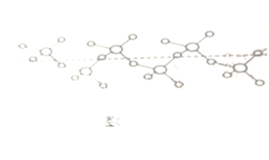
②硫和氧形成的链状化合物结构如图(C),其化学式为__________。
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF的熔点比CuCl的高,原因是_________。
②工业上将CuCl溶入KCN溶液中配制成镀铜液,镀铜液中配合物化学式为__________,写出一种与配体互为等电子体的阳离子的电子式__________。
③CuF晶胞如图(b),晶胞边长为a nm。则Cu+与F-最近的距离为________。用Mg·mol-1表示CuF的摩尔质量,NA表示阿伏加德罗常数的值,则CuF晶体的密度为______g·cm-3。
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图(b)中离子1的坐标为(![]() ,
,![]() ,0),则离子3的坐标为__________。
,0),则离子3的坐标为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列七种有机物中:
A.CH4 B.CH2=CH2 C.![]()
D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质
(1)酸性比碳酸强的是______(填字母编号,下同).
(2)易发生银镜反应的是______.(3)具有正四面体结构的是______.
(4)通常用于检验碘单质的是______.(5)可用于合成聚乙烯塑料的是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸是无色晶体,无臭、味极酸,分子结构如图所示。广泛用于食品业、化妆业等。其钙盐在冷水中比在热水中易溶解。下列有关柠檬酸的说法不正确的是
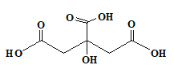
A. 易溶于水,其分子式为C6H8O7
B. 1mol该物质与足量的钠反应最多生成2molH2
C. 利用钙盐溶解性重结晶分离
D. 能作食品抗氧化剂,补酸剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com