
【题目】原子晶体是由原子直接通过共价键形成的空间网状结构的晶体,又称共价晶体,因其具有高熔沸点、硬度大、耐磨等优良特性而具有广泛的用途。
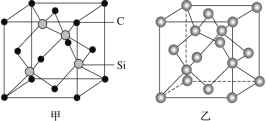
(1)晶体硅是良好的半导体材料,被广泛用于信息技术和能源科学等领域。晶体硅是与金刚石结构类似的晶体(其晶胞如图乙所示),硅晶体的1个晶胞中含_____个Si原子,在晶体硅的空间网状结构中最小环为_____元环,每最小环独立含有__________个Si原子,含1molSi原子的晶体硅中Si-Si键的数目为_____。
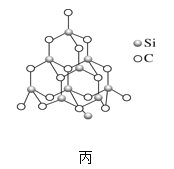
(2)金刚砂(SiC)也与金刚石具有相似的晶体结构(如图丙所示),在金刚砂的空间网状结构中,碳原子、硅原子交替以共价单键相结合。试回答下列问题:
①金刚砂、金刚石、晶体硅的熔点由低到高的顺序是_____(均用化学式表示)。
②在金刚砂的结构中,一个碳原子周围结合了_____硅个原子,其键角是_____。
③金刚砂的结构中含有C、Si原子以共价键结合形成的环,其中一个最小的环上独立含有_个C-Si键
④金刚砂的晶胞结构如图甲所示,在SiC中,每个C原子周围最近等距的C原子数目为_____;若金刚砂的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中最近的两个碳硅原子之间的距离为_________pm(用代数式表示即可)。
【答案】8 6 ![]() 2NA Si<SiC<C 4 109。28’ 1 12
2NA Si<SiC<C 4 109。28’ 1 12 
【解析】
(1)晶体硅是与金刚石结构类似的晶体(其晶胞如图乙所示),硅晶体中硅原子在顶点、面心、体内,根据结构分析得到在晶体硅的空间网状结构中最小环是几元环,每个碳原子被12个环共用,每个硅与周围四个硅形成共价键,每个硅拥有这根键的一半。
(2)①根据键长越短,键能越大,熔沸点越高;②根据在金刚砂图甲的结构得到一个碳原子周围结合了4硅个原子,形成四面体结构;③金刚砂的结构中含有C、Si原子以共价键结合形成的环,一个环里共有6个C—Si键,1个C—Si键是6个环共用;④金刚砂的晶胞结构如图甲所示,在SiC中,从顶角上的碳原子分析,每个C原子周围最近等距的C原子数目,再计算金刚砂晶胞中含有碳、硅原子数目,再计算晶胞体积,再根据晶体中最近的两个碳硅原子之间的距离为体对角的四分之一。
(1)晶体硅是与金刚石结构类似的晶体(其晶胞如图乙所示),硅晶体的1个晶胞中含![]() 个Si原子,根据结构分析得到在晶体硅的空间网状结构中最小环为6元环,每个碳原子被12个环共用,因此每最小环独立含有
个Si原子,根据结构分析得到在晶体硅的空间网状结构中最小环为6元环,每个碳原子被12个环共用,因此每最小环独立含有![]() 个Si原子,每个硅与周围四个硅形成共价键,每个硅拥有这根键的一半,即1molSi原子的晶体硅中Si—Si键的数目为2NA;故答案为:8;6;
个Si原子,每个硅与周围四个硅形成共价键,每个硅拥有这根键的一半,即1molSi原子的晶体硅中Si—Si键的数目为2NA;故答案为:8;6;![]() ;2NA。
;2NA。
(2)①根据键长越短,键能越大,熔沸点越高,因此金刚砂、金刚石、晶体硅的熔点由低到高的顺序是Si<SiC<C;故答案为:Si<SiC<C。
②根据在金刚砂图甲的结构得到一个碳原子周围结合了4个硅原子,形成四面体结构,其键角是109°28′;故答案为:4;109°28′。
③金刚砂的结构中含有C、Si原子以共价键结合形成的环,一个环里共有6个C—Si键,1个C—Si键是6个环共用,因此一个最小的环上独立含有![]() 个C—Si键;故答案为:1。
个C—Si键;故答案为:1。
④金刚砂的晶胞结构如图甲所示,在SiC中,从顶角上的碳原子分析,每个C原子周围最近等距的C原子数目为12;金刚砂晶胞中含有4个碳、4个硅,若金刚砂的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中最近的两个碳硅原子之间的距离为体对角的四分之一,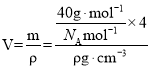 ,因此两个碳硅原子之间的距离为
,因此两个碳硅原子之间的距离为 pm;故答案为:
pm;故答案为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)人造象牙的主要成分的结构简式是![]() ,它是通过加聚反应制得的,则合成人造象牙的单体的结构简式是____________________。
,它是通过加聚反应制得的,则合成人造象牙的单体的结构简式是____________________。
(2)聚丙烯酸甲酯的结构简式可用![]() 表示,则其单体的结构简式是_________。
表示,则其单体的结构简式是_________。
(3)某药物的结构简式为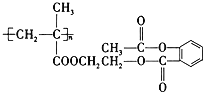 ,1 mol该物质与足量的NaOH溶液反应,消耗NaOH的物质的量为_______________。
,1 mol该物质与足量的NaOH溶液反应,消耗NaOH的物质的量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.A的结构简式是CH2=CHCH2CH3
C.A能使高锰酸钾酸性溶液退色
D.①、②的反应类型分别为取代反应、水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL浓度均为0.10 mol/LCH3COOH溶液和 HCN 溶液所得滴定曲线如图[Ka(CH3COOH)>Ka(HCN)]。下列说法正确的是
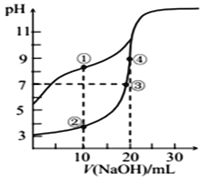
A.点①和点②所示溶液中:c(CH3COO﹣)<c(CN﹣)
B.点①和点②所示溶液中:c(CH3COO﹣)-c(CN﹣) = c(HCN)-c(CH3COOH)
C.溶液中水的电离程度:③>④
D.点③和点④所示溶液中都有:c(CH3COO﹣)+c(OH﹣) = c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
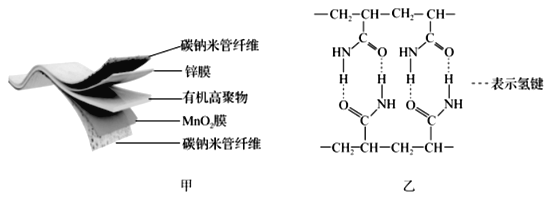
(1)Mn2+的核外电子排布式为______________;有机高聚物中C的杂化方式为_____。
(2)已知CN-与N2互为等电子体,推算拟卤素(CN)2分子中σ键与π键数目之比为____。
(3)NO2-的空间构型为__________。
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。
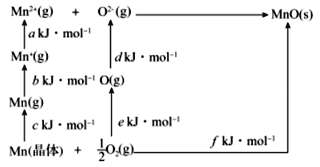
Mn的第一电离能是____,O2的键能是____,MnO的晶格能是____。
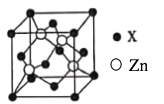
(5)锌与某非金属元素X形成的化合物晶胞如图所示,设阿伏加德罗常数的数值为NA,该晶胞中Zn的半径为r1 nm, X的半径为r2 nm,X的相对原子质量为M,则该晶体的密度为___________g·cm-3(用含r1、r2、M、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个资源宝库,海水资源的开发和利用是现代和未来永恒的主题。下面是海水利用的流程图:
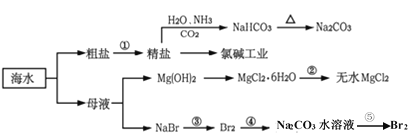
下列有关说法不正确的是
A.过程中制得NaHCO3是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生了使湿润淀粉碘化钾试纸变蓝的气体
C.反应②加热MgCl2·6H2O应在HCl气流保护下制备无水MgCl2
D.反应⑤中,用Na2CO3水溶液吸收Br2后,用70—80%硫酸富集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。经2min该反应达到平衡状态,生成0.8molD,测得C的浓度为0.8mol/L。则下列判断错误的是
A.x=4
B.2min内B的反应速率为0.1mol·L-1·min-1
C.B的转化率为40%
D.该温度下平衡常数的值为1.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3C≡CH+CO+CH3OH![]() M,N+CH3OH
M,N+CH3OH![]() M+H2O。其中M的结构简式为CH2=C(CH3)COOCH3,下列说法错误的是( )
M+H2O。其中M的结构简式为CH2=C(CH3)COOCH3,下列说法错误的是( )
A.N可以使溴水褪色
B.N转化为M的反应为取代反应
C.M中所有碳原子可能共面
D.N属于酯的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅、磷、硫、氯都是第三周期的非金属元素,它们在工农业生产中都有重要的用途。
(1) 基态硅原子的电子排布图为_________________________________________________;硫的基态原子能量最高的电子云在空间有________________个伸展方向,原子轨道呈________________形。
(2)硅、磷、硫的第一电离能由大到小的顺序为________________。
(3)单质磷与Cl2反应,可以生产PC13和PC15。其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为________________,其分子的空间构型为________________。
(4)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+核外电子排布式为__________;PO43-作为___________为Fe3+提供________________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其晶胞,硼原子与磷原子最近的距离为a cm。 用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为_________g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com