
【题目】海洋是一个资源宝库,海水资源的开发和利用是现代和未来永恒的主题。下面是海水利用的流程图:
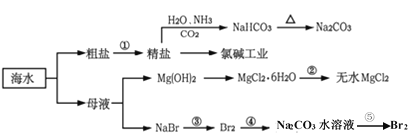
下列有关说法不正确的是
A.过程中制得NaHCO3是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生了使湿润淀粉碘化钾试纸变蓝的气体
C.反应②加热MgCl2·6H2O应在HCl气流保护下制备无水MgCl2
D.反应⑤中,用Na2CO3水溶液吸收Br2后,用70—80%硫酸富集Br2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
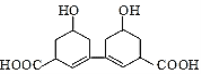
A.分子式为C14H18O6
B.1mol该有机物最多可与2mol的H2发生加成反应
C.既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应
D.1mol该有机物最多可反应2mol氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、R是短周期原子序数依次增大的主族元素,X原子最外层电子数是电子层数的2倍,Z为地壳中含量最高的元素,R的单质是短周期最活泼的金属。由W、X、Y三种元素组成的化合物甲的球棍模型如图,甲是运载火箭的燃料之一。下列说法正确的是
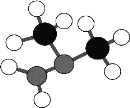
A.化合物甲分子中每个原子都达8电子的稳定结构
B.W、Y、Z三种元素可形成离子化合物
C.Y与Z只能形成2种二元化合物
D.简单离子半径:R > Z > Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或折开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为

A.-1 638 kJ/molB.+1 638 kJ/molC.-126 kJ/molD.+126 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子晶体是由原子直接通过共价键形成的空间网状结构的晶体,又称共价晶体,因其具有高熔沸点、硬度大、耐磨等优良特性而具有广泛的用途。
(1)晶体硅是良好的半导体材料,被广泛用于信息技术和能源科学等领域。晶体硅是与金刚石结构类似的晶体(其晶胞如图乙所示),硅晶体的1个晶胞中含_____个Si原子,在晶体硅的空间网状结构中最小环为_____元环,每最小环独立含有__________个Si原子,含1molSi原子的晶体硅中Si-Si键的数目为_____。
(2)金刚砂(SiC)也与金刚石具有相似的晶体结构(如图丙所示),在金刚砂的空间网状结构中,碳原子、硅原子交替以共价单键相结合。试回答下列问题:
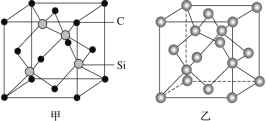
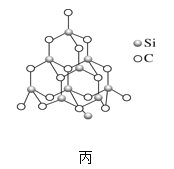
①金刚砂、金刚石、晶体硅的熔点由低到高的顺序是_____(均用化学式表示)。
②在金刚砂的结构中,一个碳原子周围结合了_____硅个原子,其键角是_____。
③金刚砂的结构中含有C、Si原子以共价键结合形成的环,其中一个最小的环上独立含有_个C-Si键
④金刚砂的晶胞结构如图甲所示,在SiC中,每个C原子周围最近等距的C原子数目为_____;若金刚砂的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中最近的两个碳硅原子之间的距离为_________pm(用代数式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.燃烧热的数值都会随反应物的用量不同而改变,故1mol S(s)和2mol S(s)的燃烧热不相等
B.已知:2C(s)+2O2(g)=2CO2(g)ΔH=akJ/mol;2C(s)+2O2(g)=2CO(g)ΔH=bkJ/mol 则a>b
C.H2(g)的燃烧热为285.8kJ/mol,则表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ/mol,在低温条件下不能自发进行,但在高温条件下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。
(1)制备硝酸铁
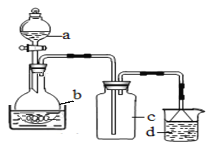
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:_______。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、_________、___________,用浓硝酸洗涤、干燥。
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是_________。
②用5mL __________溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:
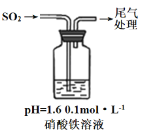
i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:_________。
⑤步骤ii后期反应的离子方程式是__________。
(3)由以上探究硝酸铁的性质实验得出的结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X。一定条件下X可分别转化为Y、Z,如下所示。
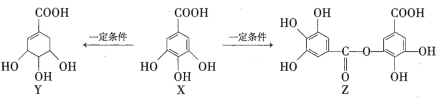
下列说法错误的是( )
A.![]() 最多能与
最多能与![]() 发生取代反应
发生取代反应
B.等物质的量的Z分别与Na和![]() 恰好反应时,消耗Na和
恰好反应时,消耗Na和![]() 的物质的量之比为6∶1
的物质的量之比为6∶1
C.一定条件下,Y能发生加成反应、取代反应、消去反应和氧化反应
D.![]() 最多能与
最多能与![]() 发生反应
发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列有机化合物,完成填空。
①CH4 ② C2H4 ③C2H2 ④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)①~⑧中,属于苯的同系物的是____ (填序号,下同)
(2)①分子的空间构型为_____,②中碳原子的杂化方式为_____。
(3)相同质量的①②③中,在相同状况下体积最小的是___,完全燃烧时消耗O2最多的是___。
(4)以⑧为原料制备TNT的化学方程式为______。
(5)④的系统命名为:____。
(6)若将CH4、O2和氢氧化钠溶液组成燃料电池,则电池的负极反应式为___。
(7)写出⑤的含有苯环的所有同分异构体______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com