
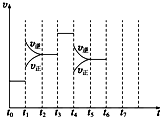
 在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:| 2x |
| a+b-2x |
| a+b-2x |
| a+b |
| 12x-2x |
| 12x |
| 5 |
| 6 |


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
| A、HOCH2CH2COOH |
| B、HOOC-CH2CH(OH)CH2COOH |
| C、HOOC-COOH |
| D、HOCH2CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
| H2 |
| 550℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 性质 | 与NaOH溶液 | 与银氨溶液 | 与钠 |
| A | 水解 | 不产生银镜 | 不反应 |
| B | 中和 | 不产生银镜 | 产生H2 |
| C | 水解 | 产生银镜 | 不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
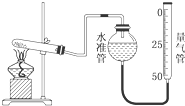 某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如图所示.部分实验步骤:①装好实验装置.②…③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为a g.④加热,开始反应,直到产生一定量的气体.⑤停止加热.⑥测量收集到的气体的体积.⑦准确称量试管和残留物的质量为b g.⑧测量实验室的温度.回答下列问题.
某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如图所示.部分实验步骤:①装好实验装置.②…③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为a g.④加热,开始反应,直到产生一定量的气体.⑤停止加热.⑥测量收集到的气体的体积.⑦准确称量试管和残留物的质量为b g.⑧测量实验室的温度.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
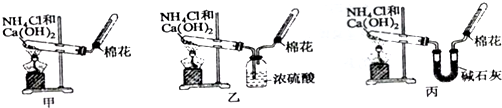
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com