
【题目】下列物质中属于纯净物的是:( )
A.液氯
B.漂白粉
C.氯水
D.盐酸
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解
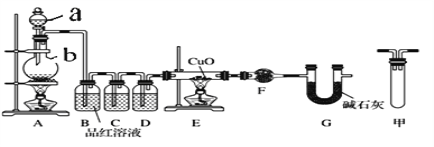
①填写仪器名称:a_____________、b_________。
②写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________。
③装置D中加入的试剂是__________。
④U型管G的作用为______________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥证明反应生成SO2和H2的实验现象是_________________。
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_____________________________________。
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)的沸点为-5.5℃,具有刺鼻恶臭味,在潮湿空气中易水解,溶于浓硫酸,是而机合成中的重要试剂。某同学用下图装置,由NO与干燥纯净的Cl2反应制备NOCl。

己知:①Cl2沸点为-34.6℃,NO2Cl沸点为-15℃
2NO+Cl2= 2NOC1 2NO2 + Cl2=2NO2C1
回答下列问题:
(1)铜与稀硝酸反应的化学方程式为_______________;装置A中设计了可上下移动的铜丝,其优点是_____________________。
(2)上图中实验装置的连接顺序为:a→_________________________。
(3)实验时,先制取氯气使充满除A、B、C外的整套装置,目的是__________________;
装置中充满氯气后,下—步是制取NO,具体操作是_______________________________;
E中冰盐水的温度可低至-22℃,其作用是________________________。
(4)该同学的实验设计可能的不足之处是________________________(答出一条即可)。
(5)若无C装置,则不利于NOCl的制备,主要原因是_________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,研究和制备物质的手段和途径越来越多,C60、H3、O、N等已被发现。下列有关说法正确的是( )
A.H2和H3互为同位素
B.O中不含化学键
C.C60中含有共价键
D.N中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置_____________________。
(2)B的原子结构示意图_____________________。
(3)E元素形成最高价氧化物对应水化物的化学式为_____________________。
(4)元素C、D、E形成的原子半径大小关系是_____________________(用元素符号表示).
(5)B、C的气态氢化物的稳定性关系为____________________(填化学式)。
(6)C、D可形成原子个数比为1:1的化合物的电子式是_____________________。
(7)写出A、C、F三种元素按原子个数比1:1:1形成化合物的结构式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,反应aA(g) ![]() bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则不正确的说法是( )
bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则不正确的说法是( )
A. 物质A的转化率小了 B. 平衡向生成A的方向移动了
C. 物质B的质量分数减小了 D. a <b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法。下列分类合理的是
A.K2CO3和K2O都属于盐 B.KOH和Na2CO3都属于碱
C.H2SO4和HNO3都属于酸 D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com