
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解
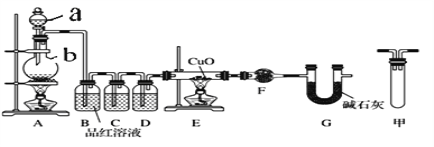
①填写仪器名称:a_____________、b_________。
②写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________。
③装置D中加入的试剂是__________。
④U型管G的作用为______________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥证明反应生成SO2和H2的实验现象是_________________。
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_____________________________________。
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:_______。
【答案】 分液漏斗 圆底烧瓶 Zn+2H2SO4(浓)![]() ZnSO4+2H2O+SO2↑ 浓硫酸 防止空气中的水蒸气进入干燥管,干扰实验 防止倒吸 B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝 1.55 mol·L-1 断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+), c(H+)的影响是主要因素 断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能。
ZnSO4+2H2O+SO2↑ 浓硫酸 防止空气中的水蒸气进入干燥管,干扰实验 防止倒吸 B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝 1.55 mol·L-1 断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+), c(H+)的影响是主要因素 断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能。
前者使溶液的温度升得更高是主要影响因素,故反应速率更快
【解析】装置A是用来 制备SO2的反应装置,
二氧化硫可使品红溶液褪色,B中品红褪色,可检验二氧化硫的存在。SO2还具有还原性,高锰酸钾氧化二氧化硫可除去二氧化硫,C中酸性高锰酸钾不再褪色后,说明二氧化硫已经除尽。锌和稀硫酸反应生成氢气和硫酸锌,装置D是干燥装置,用来除去气体通过溶液时带出的水汽,氢气通过热的氧化铜生成铜和水, E中有红色物质生成,说明有铜生成,F中无水硫酸铜变蓝,说明有水生成,即证明有氢气产生,U型管G的作用防止空气中的水蒸气进入干燥管,干扰实验。
(1)①装置A是用来 制备SO2的反应装置,a、b分别为分液漏斗,圆底烧瓶。②装置A是用来 制备SO2的反应装置,反应方程式为:Zn+2H2SO4(浓)![]() ZnSO4+2H2O+SO2↑ 。
ZnSO4+2H2O+SO2↑ 。
③装置D是干燥反应中产生的H2装置,使用的是浓硫酸作干燥剂。
④U型管G的作用为防止空气中的水蒸气进入干燥管,干扰实验。
⑤A、B间会发生倒吸的现象,在A、B间甲装置,主要是防倒吸。
⑥二氧化硫可使品红溶液褪色,可用于检验二氧化硫的存在,,若有H2产生,氢气通过热的氧化铜生成铜和水, E中有红色物质生成,说明有铜生成,F中无水硫酸铜变蓝,说明有水生成,即证明有氢气产生。
⑦反应后测得溶液c(H+)为0.1mol/L,则n剩余(H2SO4)=0.1mol/L×1L×1/2
=0.05mol,假定气体A全部为二氧化硫,根据硫原子守恒可知,生成二氧化硫的物质的量=18.5mol/L×0.1L-0.05mol=1.8mol,实际气体A的物质的量=
33.6L |
22.4L/mol |
=1.5mol,小于1.8mol,故生成气体为SO2、H2,令SO2、H2的物质的量分别为xmol、ymol,则:
Zn+2H2SO4=ZnSO4+SO2↑+H2O,
2xmol xmol
Zn+H2SO4=ZnSO4+H2↑,
ymolymol
故:x+y=1.5,2x+y=1.8,联立方程,解得:x=0.3,y=1.2故答案为:SO2=0.3mol,H2=1.2mol;
(2)根据硫原子根守恒n(H2SO4)-n(SO2)=18.5mol/L×0.1L-0.3mol=1.55mol,故1L溶液c(SO42-)= 1.55 mol·L-1
(2)①反应刚开始时,因闭合K时形成了原电池,故比断开K时,反应产生氢气的速率快;②到反应后期,先前断开K时,溶液中的c(H+)较大,随反应进行,溶液中c(H+)降低,故此时闭合K时反应速率较小;③ 在该阶段,断开K时,反应的化学能主要转化成热能;使溶液的温度升高,反应速率加快;而闭合K时,反应的化学能主要转化成电能,产生氢气速率就较慢。


科目:高中化学 来源: 题型:
【题目】世界卫生组织(WHO)将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用.ClO2属于( )
A.酸 B.氧化物 C.碱 D.盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1 Na2SO3溶液的pH约为10;0.1mol·L–1 NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 SO32–的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.H3PO2溶于水的电离方程式为:H3PO2![]() 3H++PO23-
3H++PO23-
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的氧化产物为H3PO4
D.用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2-4e-+2H2O =O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】外围电子排布式为3d104s1的元素在周期表中应位于( )
A. 第四周期ⅠB族 B. 第五周期ⅡB族
C. 第四周期ⅦB族 D. 第五周期ⅢB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想将不溶的碳酸钙通过特殊的加工方法使之变为纳米碳酸钙(即碳酸钙粒子直径是纳米级),这将引起建筑材料的性能发生巨大变化,下列关于纳米碳酸钙的推测可能的是
A.纳米碳酸钙是与胶体相似的分散系
B.纳米碳酸钙分散到水中会产生丁达尔效应
C.纳米碳酸钙化学性质已与原来碳酸钙完全不同
D.纳米碳酸钙的粒子不能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃类有机物A能发生以下转化关系:

(1)A的分子式为__________;B中含官能团名称为______________;D的结构简式为___________。
(2)写出反应②的化学方程式:_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com