
| A、1:2 | B、2:1 |
| C、1:1 | D、3:1 |


科目:高中化学 来源: 题型:
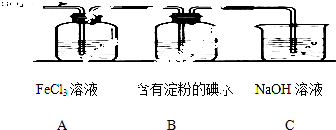
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A、由水电离出的c(H+):③<① |
| B、③稀释到原来的100倍后,pH与④相同 |
| C、①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH) |
| D、②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COOˉ)>c(H+)>c(Na+)>c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸和氢氧化钠溶液之间的中和反应 | ||||
B、CO2+C
| ||||
C、金属镁燃烧:2Mg+O2
| ||||
| D、生石灰溶于水:CaO+H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v (NH3)=0.008 mol/(L?s) |
| B、v (NO)=0.04 mol/(L?s) |
| C、v (O2)=0.006 mol/(L?s) |
| D、v (H2O)=0.06 mol/(L.min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
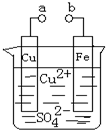
| A、a和b不连接时,铁片上会有金属铜析出 |
| B、a和b用导线连接时,溶液中的SO42-向铁电极移动,铜片上发生的反应为:Cu2++2e-=Cu |
| C、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D、a和b分别连接直流电源正、负极,溶液中的Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
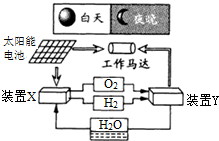
| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中电能转化为化学能 |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2 L氧气所含的原子数为 NA |
| B、1.8 g 的NH4+离子中含有的电子数为 10NA |
| C、常温常压下,48 g O3含有的氧原子数为 3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为 0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com