
【题目】下列叙述正确的是:
A. 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去
B. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C. 已知2SO2(g)+ O2(g)![]() 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和KCl溶液中滴加AgNO3溶液,最先生成Ag2CrO4沉淀
科目:高中化学 来源: 题型:
【题目】有下列物质:①浓硝酸、②福尔马林、③硝酸银、④硫酸铵、⑤硫酸铜、⑥氢氧化钠、⑦乙醇,其中不能使蛋白质变性的是( )
A. ①②B. ④⑤C. ④D. ④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是一种重要的化工产品。常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,易与水反应,进一步氯化可得SCl2。SCl2是樱桃红色液体,易挥发,熔点-122℃,沸点59℃。SCl2 与S2Cl2相似,有毒并有恶臭,且更不稳定。S2Cl2可用下列装置制备。
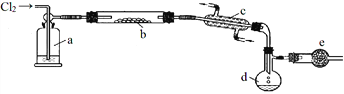
回答下列问题:
(1)写出S2Cl2的电子式________________;装置a中的试剂是________________。
(2)写出实验室制取Cl2的离子反应方程式________________________
(3)装置b中发生反应前,需进行的操作是________________________;
(4)装置e作用是___________________________;
(5)为了获得到纯净的S2Cl2,需要进行的操作名称是________________;
(6)将S2Cl2放入水中会产生沉淀和气体,写出S2Cl2与水反应的化学方程式________________。检验所产生的气体的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃,H2A的电离常数Kl=6.0×10-2,K2=6.0×10-5。此温度下,将1 mL浓度为0.1mol/L, 的H2A溶液加水稀释到1000mL。下列说法正确的是
A. 上述稀释过程中,H2A分子及所有离子浓度均减小
B. 上稀释过程中,![]() 的变化趋势保持增大
的变化趋势保持增大
C. 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-)
D. 根据H2A的电离常数,可推知0.1mol/L NaHA溶液的pH值大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在S2、Fe2+、Fe3+、Mg2+、S、I、H+中,只有氧化性的是____________,只有还原性的是____________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是____________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______________。
①2FeCl3+2KI![]() 2FeCl2+2KCl+I2
2FeCl2+2KCl+I2
②2FeCl2+Cl2![]() 2FeCl3
2FeCl3
③2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl与I共存,为了氧化I而Cl不被氧化,除单质外,还应用上述反应中的__________作氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该小组按上图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如下表。(已知饱和NaClO溶液pH为11)
实验步骤 | 实验现象 | ||
B瓶 | C瓶 | D瓶 | |
实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
实验2:取样,测定溶液的pH | 3 | 12 | 7 |
① 装置A中反应的化学方程式为________。
② B瓶溶液中H+的主要来源是________。
③ C瓶溶液的溶质是________(填化学式)。
④ 结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因________。
(2)测定C瓶溶液中NaClO含量(单位:g·L-1)的实验步骤如下:
Ⅰ.取C瓶溶液20 mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000 mol·L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00 mL Na2S2O3溶液。(I2+2S2O32-==2I-+S4O62-)
① 步骤Ⅰ总反应的离子方程式为_______,盖紧瓶塞并在暗处反应的原因是________。
② C瓶溶液中NaClO的含量为________g·L-1。(保留1位小数。NaClO式量为74.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案:

(1)操作①为________。
(2)操作②~④加入的试剂可以分别为________。
(3)如何判断![]() 已除尽,简述实验操作________________________。
已除尽,简述实验操作________________________。
(4)实验过程中产生的多次沉淀________(填“需要”或“不需要”)多次过滤,理由是_____________________。
(5)该同学设计的实验方案________(填“合理”或“不合理”),理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项有机物数目,与分子式为C4H7O2Cl且能与碳酸氢钠反应生成气体的有机物数目相同的是
A. 甲苯苯环上的两个氢原子被氯原子取代 B.  的二氯代物
的二氯代物
C. 分子式为C5H10 的烯烃 D. 金刚烷(![]() )的二氯代物
)的二氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl

实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com