
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案:

(1)操作①为________。
(2)操作②~④加入的试剂可以分别为________。
(3)如何判断![]() 已除尽,简述实验操作________________________。
已除尽,简述实验操作________________________。
(4)实验过程中产生的多次沉淀________(填“需要”或“不需要”)多次过滤,理由是_____________________。
(5)该同学设计的实验方案________(填“合理”或“不合理”),理由是____________________________。
【答案】
(1)(加水)溶解
(2)Ba(NO3)2、K2CO3、KOH[或KOH、Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3]
(3)取少许滤液,向其中加入少量Ba(NO3)2溶液,若不变浑浊,表明![]() 已除尽
已除尽
(4)不需要 生成的沉淀可一次性过滤,如果分步过滤会使操作复杂化
(5)不合理 调节溶液的pH不能用盐酸,而应该用硝酸,否则会引入Cl
【解析】
(1)实验要在溶液中进行,故首先要将试剂溶解。
(2)![]() 可用Ba2+除去,Mg2+可用OH除去。为了不引入新杂质,可分别选用Ba(NO3)2、KOH。过量的Ba(NO3)2可用K2CO3除去。Ba(NO3)2必须在加入K2CO3之前加入,而KOH可在加入Ba(NO3)2之前或在加入K2CO3之后或在Ba(NO3)2和K2CO3中间加入。
可用Ba2+除去,Mg2+可用OH除去。为了不引入新杂质,可分别选用Ba(NO3)2、KOH。过量的Ba(NO3)2可用K2CO3除去。Ba(NO3)2必须在加入K2CO3之前加入,而KOH可在加入Ba(NO3)2之前或在加入K2CO3之后或在Ba(NO3)2和K2CO3中间加入。
(3)如果![]() 除尽,则滤液中不含
除尽,则滤液中不含![]() ,向滤液中加入可溶性钡盐,没有白色沉淀生成。
,向滤液中加入可溶性钡盐,没有白色沉淀生成。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】下列有关以碱金属元素的性质,从上到下递变规律正确的是
A. 金属性逐渐减弱
B. 化合价逐渐升高
C. 失电子能力逐渐增强
D. 最高价氧化物对应的水化物碱性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是:
A. 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去
B. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C. 已知2SO2(g)+ O2(g)![]() 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和KCl溶液中滴加AgNO3溶液,最先生成Ag2CrO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石与石墨是碳元素的两种结构不同的单质,彼此互称同素异形体。在100 kPa时,1 mol石墨转化为金刚石要吸收1.895 kJ的热能。据此判断在100 kPa压强下,下列说法正确的是
A.金刚石比石墨更稳定
B.石墨比金刚石更稳定
C.1 mol金刚石比1 mol石墨的总能量低
D.1 mol金刚石转变为石墨需要吸收1.895 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应3Fe2++2S2O32-+O2+aOH-=Fe3O4+S4O62-+2H2O是水热法制备Fe3O4纳米颗粒的原理。下列说法正确的是( )
A. 参加反应的Fe2+全部作还原剂
B. 生成1.5molFe3O4时,反应转移电子 6mol电子
C. 方程式中a=2
D. 反应中被氧化的元素是Fe,被还原的元素是S和O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
![]()
其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X ,沉淀A 。
(2)上述实验流程中①②③步均要进行的实验操作是 (填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是 。
(4)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的 (填化学式),之后若要获得NaNO3晶体,需进行的实验操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液。则A、B、C分别可能为
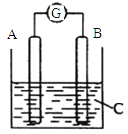
A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是AgNO3稀溶液
D.A是Ag,B是Fe,C是AgNO3稀溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com